题目内容
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。滤出小苏打后,母液提取氯化铵有两种方法:
① 通入氨,冷却、加食盐,过滤 ② 不通氨,冷却、加食盐,过滤
对上述两种方法评价中错误的是
A.①析出的氯化铵纯度更高 B.①的滤液可直接循环使用
C.②析出的氯化铵纯度不高 D.②的滤液可直接循环使用
B
【解析】
试题分析:在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),由于物质的溶解度:NH4HCO3> NaHCO3,所以会发生反应: NaCl+NH4HCO3= NaHCO3↓+NH4Cl。滤出小苏打后在滤液中存在盐的水解平衡:NH4++H2O NH3?H2O+OH-。向其中通入氨气,冷却、加食盐,由于氨气与水反应产生一水合氨,使c(NH3?H2O)增大,平衡逆向移动,因此更有利于氯化铵的析出,而且纯度更高。过滤后的滤液中含有氨气分子及一水合氨分子,因此①的滤液不可直接循环使用,而②的滤液可直接循环使用,故错误选项是B。
NH3?H2O+OH-。向其中通入氨气,冷却、加食盐,由于氨气与水反应产生一水合氨,使c(NH3?H2O)增大,平衡逆向移动,因此更有利于氯化铵的析出,而且纯度更高。过滤后的滤液中含有氨气分子及一水合氨分子,因此①的滤液不可直接循环使用,而②的滤液可直接循环使用,故错误选项是B。
考点:考查以精制饱和食盐水为原料制取碳酸氢钠的操作方法及正误判断的知识。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案(12分)实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4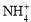 + 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
+ 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+ 相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
滴定次数 | 待测液的体积(mL) | 标准溶液的体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
根据上述实验步骤填空:
(1)滴定操作时,眼睛应观察
(2)滴定终点的判断方法是
(3)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(4)碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分
数 (填“偏大”、“偏小”或“无影响”)
(5)配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、滴定管外,
还有 (填仪器名称)
(6)该样品中氮的质量分数为


 [Cu(NH3)3CO]Ac;若要提高上述反应的正反应速率,可采取的措施是
[Cu(NH3)3CO]Ac;若要提高上述反应的正反应速率,可采取的措施是 B.
B. C.
C. D.
D.