题目内容
下列说法正确的是( )
| A、把100mL3mol?L-1的H2SO4跟100mL水混合,硫酸的物质的量浓度变为1.5 mol?L-1 |
| B、把200mL3mol?L-1的BaCl2溶液跟100mL3mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol?L-1 |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% |
考点:溶液中溶质的质量分数及相关计算,物质的量浓度的相关计算
专题:计算题
分析:A、硫酸和水等体积混合,总体积小于200mL;
B、200mL3mol?L-1的BaCl2溶液跟100mL3mol?L-1的KCl溶液中氯离子的浓度不相同;
C、稀释中溶质的质量不变,溶液质量变为原来2倍,根据质量分数的定义判断;
D、氢氧化钠溶液的密度与水的密度不相同.
B、200mL3mol?L-1的BaCl2溶液跟100mL3mol?L-1的KCl溶液中氯离子的浓度不相同;
C、稀释中溶质的质量不变,溶液质量变为原来2倍,根据质量分数的定义判断;
D、氢氧化钠溶液的密度与水的密度不相同.
解答:
解:A、将硫酸和水等体积混合,总体积小于200mL,则把100mL3mol?L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度大于1.5mol?L-1,故C错误;
B、3mol?L-1的BaCl2溶液中氯离子浓度为6mol?L-1,3mol?L-1的KCl溶液中氯离子浓度为L3mol?L-1,混合后氯离子浓度介于之间3mol?L-1~6mol?L-1,故B错误;
C、稀释中溶质的氯化钠质量不变为20g,溶液质量变为原来2倍,为200g,所以混合后,NaCl溶液的质量分数是10%,故C正确;
D、氢氧化钠溶液的密度与水的密度不相同,不知道氢氧化钠溶液的密度,无法计算具体值,由于氢氧化钠的密度比水的大,根据质量分数的定义可推断混合后质量分数大于10%,故D错误.
故选C.
B、3mol?L-1的BaCl2溶液中氯离子浓度为6mol?L-1,3mol?L-1的KCl溶液中氯离子浓度为L3mol?L-1,混合后氯离子浓度介于之间3mol?L-1~6mol?L-1,故B错误;
C、稀释中溶质的氯化钠质量不变为20g,溶液质量变为原来2倍,为200g,所以混合后,NaCl溶液的质量分数是10%,故C正确;
D、氢氧化钠溶液的密度与水的密度不相同,不知道氢氧化钠溶液的密度,无法计算具体值,由于氢氧化钠的密度比水的大,根据质量分数的定义可推断混合后质量分数大于10%,故D错误.
故选C.
点评:本题考查物质的量浓度与质量分数混合计算,浓度不大,注意溶液混合体积不具备加合性.

练习册系列答案
相关题目
有关下列图象的说法正确的是( )
A、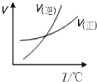 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、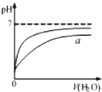 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
C、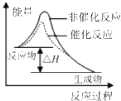 表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
D、 中开关K置于a或b处均可减缓铁的腐蚀 |
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A、加入水中,浮在水面上的是地沟油 |
| B、测定沸点,有固定沸点的是矿物油 |
| C、加入足量氢氧化钠溶液共热,不分层的是地沟油 |
| D、点燃,能燃烧的是矿物油 |
有100mL 3mol?LNaOH溶液和100mL 1mol?L-1 AlCl3溶液.按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中.比较两次实验的结果是( )
| A、现象相同,沉淀量相等 |
| B、现象不同,沉淀量不等 |
| C、现象相同,沉淀量不等 |
| D、现象不同,沉淀量相等 |
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,下列说法错误的是( )
| 元素 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、若元素Y处于第三周期,则它可与冷水剧烈反应 |
| B、元素Y是第ⅢA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素X的常见化合价是+1价 |
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉.对加入铁粉充分反应后的分析合理的是( )
| A、若溶液中有Fe3+,则一定有Cu析出 |
| B、若溶液中只含Fe2+、Cu2+,则固体可能存在 |
| C、若有固体析出,则溶液中一定没有Cu2+ |
| D、若溶液中只有Fe2+,则固体一定只含Cu |
下列说法正确的是( )
| A、强电解质一定易溶于水 |
| B、钢铁在海水中发生电化腐蚀时,铁是阳极被氧化 |
| C、对可逆反应,升高温度一定存在v(正)>v(逆) |
| D、相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
现有六种物质:①液氧;②澄清的石灰水;③食盐水;④纯碱;⑤氢氧化钾;⑥牛奶.对上述物质的分类全部正确的是( )
| A、盐--③④ |
| B、混合物--②③⑥ |
| C、碱--④⑤ |
| D、纯净物--④⑤⑥ |