题目内容
16.在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( )| A. | 耐高温的材料 | B. | 半导体 | C. | 催化剂 | D. | 农药 |
分析 本题根据元素周期表中的元素分布及元素常见的性质来解题,一般金属延展性较好,可用于做合金,金属元素和非金属元素交界处的元素可以制作半导体材料,一般过度金属可以用来做催化剂,农药分为有机和无机,一般非金属元素可以制作有机农药.
解答 解:A.在过渡元素找中耐高温的材料,故A错误;
B.在金属元素和非金属元素交接区域的元素可以用来做良好的半导体材料,像硅等,故B正确;
C.可以用于做催化剂的元素种类较多,一般为过渡金属元素,故C错误;
D.非金属元素位于右上方,非金属可以制备有机溶剂,部分有机溶剂可以用来做农药,故D错误.
故选B.
点评 本题考察了元素周期表中,如硅等,位于金属元素和非金属元素交接区域,用来做良好的半导体材料;非金属可以制备有机溶剂,部分有机溶剂可以用来做农药;
一般为过渡金属元素可以用于做催化剂,比较容易.

练习册系列答案
相关题目
4.下列各组物质不属于同分异构体的是( )
| A. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| B. | 对氯甲苯和邻氯甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 甲基丙烯酸和甲酸丙酯 |
1.表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素是Ar.(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是Na>Mg>F (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程 .
.
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH.(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2(填化学式),可用什么化学反应说明(写出反应的化学方程式):Cl2+2Br-=2Cl-+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)②③④三种元素的原子半径从大到小的顺序是Na>Mg>F (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程
 .
.(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH.(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2(填化学式),可用什么化学反应说明(写出反应的化学方程式):Cl2+2Br-=2Cl-+Br2.
5.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与ⅦA族元素间形成的化合物都是离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子从上到下还原性减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
6.在25℃、101k Pa下,0.2mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 0.2C2H2(g)+0.5O2(g)═0.4CO2(g)+0.2H2O(g)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)═0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599.2 kJ/mol |
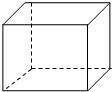 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: .
.