题目内容
16.有一真空瓶的质量为M克,该瓶充入空气后总质量为M1克,在相同条件下改充某气体后总质量为M2克,此气体的摩尔质量是( )| A. | [M1-$\frac{M}{{M}_{2}}$-M]×29 | B. | [M2-$\frac{M}{{M}_{1}}$-M]×29g/mol | ||
| C. | [M2-$\frac{M}{{M}_{1}}$-M]×29 | D. | [M1-$\frac{M}{{M}_{2}}$-M]×29 g/mol |
分析 根据题意,有一真空瓶质量为M,该瓶充入空气后质量为M1.在相同状况下,若改为充入某气体时,总质量为M2.根据空气和此气体的体积相同,即物质的量相同,而当物质的量相同时,物质的质量之比等于摩尔质量之比来计算.
解答 解:有一真空瓶质量为M,该瓶充入空气后质量为M1,故空气的质量为(M1-M)g;在相同状况下,若改为充入某气体时,总质量为M2,故此气体的质量为(M2-M)g,由于空气和此气体的体积相同,故物质的量也相同,而当物质的量相同时,物质的质量之比等于摩尔质量之比,设此气体的摩尔质量为Xg/mol,故有:$\frac{{M}_{1}-M}{{M}_{2}-M}=\frac{29}{X}$,解得X=$\frac{29({M}_{2}-M)}{{M}_{1}-M}$,故选B.
点评 本题难度不大,掌握分子的实际质量与相对分子质量呈正比是正确解答本题的关键.

练习册系列答案
相关题目
6.最近科学家开发出一种新型的燃料电池-固体氧化物电池,该电池用辛烷(C8H18)作燃料,电池中间部分为固体氧化物陶瓷,可传递氧离子.下列说法中正确的是( )
| A. | 电池工作时,氧气发生氧化反应 | |
| B. | 电池正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池负极的电极反应为:2C8H18+50 O2-═16CO2+18H2O+100 e- | |
| D. | 若消耗的O2为11.2 L (标准状况),则电池中有1 mol电子发生转移 |
4.化学试剂不变质和实验方法科学是化学实验成功的保障.下列试剂保存方法或实验方法中,不正确的是( )
| A. | 实验室中金属钠通常保存在煤油里 | |
| B. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处 |
1.下列物质既可以做防腐剂,又可以做调味剂的是( )
| A. | 食盐 | B. | 亚硝酸钠 | C. | 柠檬黄 | D. | 味精 |
19.下列叙述中正确的是( )
| A. | 摩尔是物质的量的单位,每摩尔物质含有6.02×1023个分子 | |
| B. | 1 mol氧的质量为16 g | |
| C. | 0.5 molHe约含有6.02×1023个电子 | |
| D. | 2H既可表示2个氢原子又可表示2 mol氢分子 |
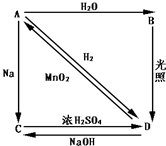 常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
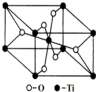 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: