题目内容
4.乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图1所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油[X& | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
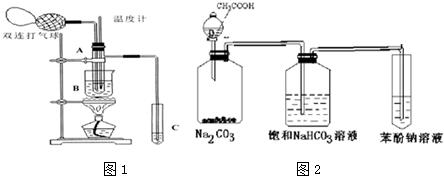
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{68℃-80℃}^{CuO}$2CH3COOH.
(2)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(3)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用ad.(填序号).实验仪器任选.所提供的试剂和试纸有:
a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末.
(4)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱.
①饱和碳酸氢钠溶液的作用是除去乙酸.
②苯酚钠溶液中应观察到溶液变浑浊,有关的化学方程式C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
分析 (1)根据乙醛与氧气发生氧化反应生成乙酸;
(2)B中装的液体直接受热,可以让试管A内的反应液均匀受热发生反应,根据乙酸的沸点为117.9℃,还可以使生成的乙酸蒸气进入试管;若通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃;
(3)根据乙酸具有酸的通性来解答;
(4)根据强酸制弱酸,乙酸和碳酸钠反应生成二氧化碳,说明乙酸的酸性大于碳酸,乙酸易挥发,导致二氧化碳中含有乙酸,用饱和碳酸氢钠溶液除去乙酸,二氧化碳和苯酚钠溶液反应生成苯酚和碳酸氢钠,苯酚微溶于水,出现浑浊,说明碳酸的酸性大于苯酚.
解答 解:(1)乙醛与氧气发生氧化反应生成乙酸,方程式为:2CH3CHO+O2$→_{68℃-80℃}^{CuO}$2CH3COOH,故答案为:2CH3CHO+O2$→_{68℃-80℃}^{CuO}$2CH3COOH;
(2)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;乙酸的沸点为117.9℃,若通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油;
故答案为:使生成的乙酸蒸气进入试管;乙二醇或甘油;
(3)乙酸能使PH试纸变红,乙酸能与碳酸氢钠粉末反应产生气泡,与红色石蕊试纸、白色的醋酸铅试纸无现象;故选:ad;
(4)乙酸和碳酸钠反应生成二氧化碳,说明乙酸的酸性大于碳酸,乙酸易挥发,导致二氧化碳中含有乙酸,用饱和碳酸氢钠溶液除去乙酸,二氧化碳和苯酚钠溶液反应生成苯酚和碳酸氢钠,方程式为:C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3,苯酚微溶于水,出现浑浊,说明碳酸的酸性大于苯酚;
故答案为:①除去乙酸;②溶液变浑浊;C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
点评 本题借助于乙酸的制备,考查了蒸馏的原理、温度计的使用,乙酸的性质及检验质,难度不大,根据课本知识即可完成.

| A. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液 | |
| B. | 过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显红色 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质为“蓝色固体” |
| A. | 加KSCN显红色的溶液中:K+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中:K+、Fe3+、Cl-、NO3- | |
| C. | “84”消毒液的溶液中:Fe2+、Cl-、Ca2+、Na+ | |
| D. | 含有大量NH4+的溶液中:Ba2+、K+、Cl-、OH- |
| A. | SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 | |
| B. | 由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 | |
| C. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| D. | 金属钠通常被保存在煤油中,以隔绝空气 |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |

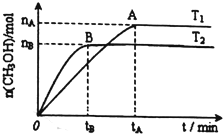 科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.
科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.