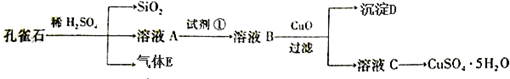
题目内容
16.常温下下列各组离子能大量共存的是( )| A. | 加KSCN显红色的溶液中:K+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中:K+、Fe3+、Cl-、NO3- | |
| C. | “84”消毒液的溶液中:Fe2+、Cl-、Ca2+、Na+ | |
| D. | 含有大量NH4+的溶液中:Ba2+、K+、Cl-、OH- |
分析 A.加KSCN显红色的溶液,含铁离子;
B.pH=1的溶液,显酸性;
C.“84”消毒液具有氧化性;
D.离子之间结合生成弱电解质.
解答 解:A.加KSCN显红色的溶液,含铁离子,Fe3+、S2-发生氧化还原反应,不能大量共存,故A错误;
B.pH=1的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.“84”消毒液具有氧化性,与Fe2+发生氧化还原反应,不能大量共存,故C错误;
D.NH4+、OH-结合生成弱电解质,不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应的离子共存及分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.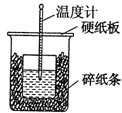 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
(6)下列操作能引起△H偏大的是:①②③(填序号)操作.
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
| 实验 次数 | 起始温度t1/℃ | 终止温度t2/℃] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.6 |
| 2 | 20.3 | 20.3 | 23.7 |
| 3 | 20.3 | 20.3 | 25.9 |
| 4 | 20.3 | 20.3 | 23.8 |
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
7.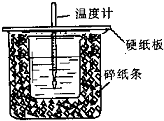 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
①已知反应后溶液的比热容为4.18J•℃-1•g-1,各溶液密度均近似为1g•cm-3,计算完成上表(保留一位小数,将结果填写在表格中横线上)
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)
 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃仪器的名称是
环形玻璃搅拌棒,碎纸条的作用是减少实验过程中的热量损失,如果大烧杯上不盖硬纸板,实验所测得的中和热会偏大(填“偏大”、“偏小”或“无影响”).
(2)实验数据记录如下表(t1为混合前两溶液平均温度,t2为混合充分反应后读取的温度):
| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
②强酸与强碱反应的中和热理论值为-57.3kJ•mol-1,下面列举的情况中可能造成上述实验结果与理论值的差距的是ABC(填字母序号)
A.倒入反应溶液时有少许溅出
B.倒入NaOH溶液时速度缓慢
C.未在温度达到最高点时读数
③现用一定量的稀氢氧化钾溶液、澄清石灰水代替氢氧化钠溶液,分别与上述实验的盐酸恰好完全反应时的反应热分别为△H1、△H2,则理论上两者的大小关系为:△H1=△H2(填“<”“>”或“=”)
11.下列离子方程式正确的是( )
| A. | 用Al作电极电解NaHCO3溶液:2Al+6H2O═2Al(OH)3↓+3H2↑ | |
| B. | 向明矾溶液中加入氢氧化钡溶液至沉淀质量最大时:2Al3++2SO42-+2Ba2++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| C. | 碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O | |
| D. | 酸性高锰酸钾溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
1.若NA代表阿伏伽德罗常数,则下列有关阿伏伽德罗常数的说法正确的是( )
| A. | 1molNa与足量氧气充分反应转移电子数目为NA | |
| B. | 1L0.1mol/LHCl溶液中含0.1NAHCl分子 | |
| C. | 100ml 1mol/L盐酸与0.1molNa2CO3无论如何滴加都产生0.05NA的CO2分子 | |
| D. | 0.1mol/L的AlCl3中Cl-的物质的量为0.3NA |
4.乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图1所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
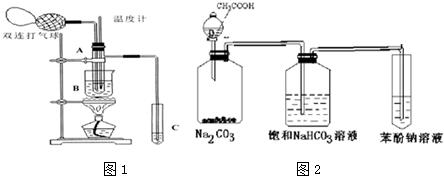
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{68℃-80℃}^{CuO}$2CH3COOH.
(2)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(3)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用ad.(填序号).实验仪器任选.所提供的试剂和试纸有:
a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末.
(4)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱.
①饱和碳酸氢钠溶液的作用是除去乙酸.
②苯酚钠溶液中应观察到溶液变浑浊,有关的化学方程式C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
| 物质 | 乙醛 | 乙酸 | 甘油[X& | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{68℃-80℃}^{CuO}$2CH3COOH.
(2)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(3)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用ad.(填序号).实验仪器任选.所提供的试剂和试纸有:
a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末.
(4)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱.
①饱和碳酸氢钠溶液的作用是除去乙酸.
②苯酚钠溶液中应观察到溶液变浑浊,有关的化学方程式C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
3.下列叙述正确的是( )
| A. | 含1.2NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为0.6mol•L-1 | |
| B. | Na在空气中长期放置变成Na2CO3粉末 | |
| C. | 过量的澄清石灰水分别与Na2CO3溶液和NaHCO3溶液反应,现象不同 | |
| D. | 滴加KSCN显红色的溶液中可大量存在NH4+、K+、Cl-、I- |