题目内容
11.有A、B、C三种元素.已知:①4g A元素的单质与水作用,标准状况下放出氢气2.24L,反应中有1.204×1023个电子发生转移;②B元素可与A形成AB2型的离子化合物,且知A、B的离子具有相同的核外电子排布;③元素C的气态氢化物可与其最高价氧化物的水化物发生非氧化还原反应生成盐,1mol该盐含42个电子.据此填写下列空白:(1)写出元素符号:ACa,BCl,CN.
(2)C的气态氢化物在催化剂作用下与氧气反应的化学方程式4NH3+5O2=$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)用电子式表示B的气态氢化物的形成过程
 .
.(4)写出B的气态氢化物与C的气态氢化物反应生成物中所含化学键种类(填离子键,极性共价键或非极性共价键)离子键和极性键.
分析 有A、B、C三种元素,①4g A元素的单质与水作用,在标准状况下放出氢气2.24L,反应中有1.204×1023个电子发生转移,转移电子物质的量=$\frac{1.204×10{\;}^{23}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=0.2mol,A为金属元素,令其摩尔质量为ag/mol、化合价为n,则$\frac{4}{a}$×n=0.2,n=2、a=40符合题意,可知A为Ca;②B元素可与A元素形成AB2型的离子化合物,B表现-1价,且A、B的离子具有相同的核外电子排布,则B为Cl;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,则C为N元素,1mol该盐含有42mol电子,该盐为NH4NO3,据此答题.
解答 解:有A、B、C三种元素,①4g A元素的单质与水作用,在标准状况下放出氢气2.24L,反应中有1.204×1023个电子发生转移,转移电子物质的量=$\frac{1.204×10{\;}^{23}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=0.2mol,A为金属元素,令其摩尔质量为ag/mol、化合价为n,则$\frac{4}{a}$×n=0.2,n=2、a=40符合题意,可知A为Ca;②B元素可与A元素形成AB2型的离子化合物,B表现-1价,且A、B的离子具有相同的核外电子排布,则B为Cl;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,则C为N元素,1mol该盐含有42mol电子,该盐为NH4NO3,
(1)根据上面的分析可知,A.Ca B.Cl C.N,
故答案为:Ca;Cl;N;
(2)C为N元素,C的气态氢化物为NH3,在催化剂作用下与氧气反应的化学方程式为4NH3+5O2=$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2=$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)用电子式表示HCl的形成过程为 ,
,
故答案为: ;
;
(4)写出B的气态氢化物为HCl,与C的气态氢化物为NH3,反应生成物为NH4Cl,NH4Cl中所含化学键种类为离子键和极性键,
故答案为:离子键和极性键.
点评 本题考查元素的推断,计算确定A为Ca元素是关键,难度不大,注意对基础知识的掌握.

 名校课堂系列答案
名校课堂系列答案| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 澄清石灰水与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| A. | 食用植物油是人体的营养物质 | |
| B. | 分馏、干馏是物理变化,裂化、裂解是化学变化 | |
| C. | 淀粉、蛋白质、葡萄糖都是高分子化合物 | |
| D. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 |
| A. | 麦芽糖和稀硫酸共热 | |
| B. | 蛋白质溶液中加入饱和NaCl溶液,有沉淀析出 | |
| C. | 蛋白质溶液中加入浓NaOH溶液 | |
| D. | 氨基酸中加入盐酸 |
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 达到平衡时,O2的转化率是31.5% | |
| C. | 达到平衡时,SO2的转化率是31.5% | |
| D. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 |

| A. | 乙醇 | B. | 盐酸 | C. | NaOH | D. | HNO3 |
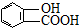 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥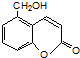

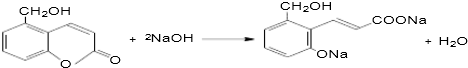
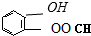 、
、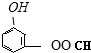 、
、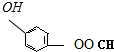
 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2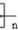 OH.
OH.