题目内容
10.下列除杂方案错误的是( )| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | - | 灼烧 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CO2与NaOH反应,CO不能,且浓硫酸可干燥CO;
B.氯化铵、铁离子均与NaOH反应;
C.饱和食盐水除去HCl,抑制氯气的溶解;
D.碳酸氢钠加热分解生成碳酸钠.
解答 解:A.CO2与NaOH反应,CO不能,且浓硫酸可干燥CO,则洗气可除杂,故A正确;
B.氯化铵、铁离子均与NaOH反应,不能除杂,应选氨水、过滤,故B错误;
C.饱和食盐水除去HCl,抑制氯气的溶解,再利用浓硫酸干燥,洗气可除杂,故C正确;
D.碳酸氢钠加热分解生成碳酸钠,则加热可除杂,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
20.下列物质转化在给定条件下能实现的是( )
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{点燃}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH}{→}$Fe(OH)2$\stackrel{空气中的灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
1.如图所示装置,有关说法错误的是( )
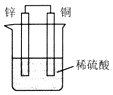

| A. | 锌是负极,其质量逐渐减少 | |
| B. | 电子由铜片经导线流向锌片 | |
| C. | H+在铜片表面被还原,产生气泡 | |
| D. | 锌片上发生氧化还原,铜片上发生还原反应 |
18.t℃时,某浓度氯化铵溶液的pH=4,下列说法中一定正确的是( )
| A. | 由水电离出的氢离子浓度为10-10 mol•L-1 | |
| B. | 溶液中c(H+)•c(OH-)=1×10-14 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 溶液中c(NH3•H2O)+c(NH4+)=c(Cl-)+c(OH-) |
5.下列反应的离子方程式表示正确的是( )
| A. | 用惰性电极电解NaCl溶液2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+ | |
| C. | 用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O=2Cr3++6Fe3++14OH- | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
2. 固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )
固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )
 固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )
固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )| A. | 该燃料电池的负极反应式为CH3OH-6e-+3O2-═CO2↑+2H2O | |
| B. | 若有16g甲醇发生反应,该电池理论上提供的电量最多为2.895×105C | |
| C. | 氧气在负极发生还原反应 | |
| D. | O2-在电解质中的移动方向为:正极→负极 |
10.如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,下列说法错误的是( )

| A. | 该装置可将化学能转化为电能 | |
| B. | 正极反应式为:O2+4e-+4H+═H2O | |
| C. | 每消耗 0.2 mol CH2=CH2,则溶液中有 0.4 mol e-迁移 | |
| D. | 放电一段时间后磷酸的物质的量不变 |
