题目内容
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中,b的离子半径大于e的离子半径;d是由共价键构成的四原子分子;c与f可形成两个共价型的g分子.
(1)a微粒的结构示意图为 .
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为 > .
(3)f的电子式为 .
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)a微粒的结构示意图为
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为
(3)f的电子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:a是单核且含有10电子的微粒,则a是Ne;
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,结合元素周期律解答.
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,结合元素周期律解答.
解答:
解:a是单核且含有10电子的微粒,则a是Ne;
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为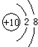 ,故答案为:
,故答案为: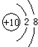 ;
;
(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性NaOH>Mg(OH)2,故答案为:NaOH;Mg(OH)2;
(3)f是H3O+,其电子式为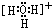 ,故答案为:
,故答案为: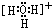 .
.
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为
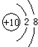 ,故答案为:
,故答案为: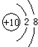 ;
;(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性NaOH>Mg(OH)2,故答案为:NaOH;Mg(OH)2;
(3)f是H3O+,其电子式为
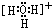 ,故答案为:
,故答案为: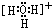 .
.
点评:本题考查了常见10电子微粒,涉及电子式、原子结构示意图、元素周期律的考查,知道常见10电子、18电子的微粒有哪些,灵活运用知识解答,注意:复杂阳离子电子式要写上[],为易错点.

练习册系列答案
相关题目
下列化学方程式或离子方程式正确的是( )
A、苯酚钠溶液中通入少量二氧化碳的离子方程式: |
B、制备酚醛树脂的化学方程式: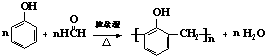 |
C、丙烯聚合成聚丙烯的化学方程式: |
| D、丙烯与溴化氢主反应为:CH3-CH=CH2+HBr→CH3-CH2-CHBr |