题目内容
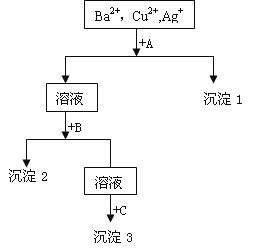
【题目】立德粉ZnS.BaSO4(也称锌钡白),是一种常用白色颜料。以重晶石(BaSO4)为原料生产立德粉的工艺流程如下:
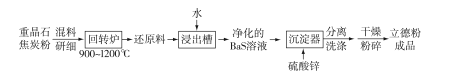
(l)在回转炉中重晶石与过量焦炭反应生成可溶性硫化钡和一种有毒气体。
①有关反应的化学方程式为____。
②生产上可通过水蒸气变换反应将有毒气体转化为CO2和一种清洁能源气体,提纯该清洁能源气体的方法是____。
(2)在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,有关反应的化学方程式为____。
(3)沉淀器中反应的离子方程式为____。
(4)称取0.71 g立德粉样品,加入25. 00 mL0.10 mol/L酸化的I2-KI溶液,有单质硫析出,过量的I2恰好与8. 00 mL0.l0 mol/L Na2S2O3溶液反应(相关反应为![]() )。则样品中S2-的质量分数为_____结果保留2位有效数字)。
)。则样品中S2-的质量分数为_____结果保留2位有效数字)。
【答案】BaSO4+4C ![]() BaS+4CO↑ 将所得气体依次通入NaOH溶液和浓硫酸(或其它合理答案) BaS+H2O+CO2= BaCO3+H2S S2-+Ba2++Zn2++SO42-=BaSO4·ZnS↓ 9.5%
BaS+4CO↑ 将所得气体依次通入NaOH溶液和浓硫酸(或其它合理答案) BaS+H2O+CO2= BaCO3+H2S S2-+Ba2++Zn2++SO42-=BaSO4·ZnS↓ 9.5%
【解析】
流程重晶石与焦炭在回转炉中反应,生成还原料BaS,用水浸取并净化后得到的BaS溶液与硫酸锌发生复分解反应:S2-+Ba2++Zn2++SO42-=BaSO4·ZnS↓,进一步处理得到立德粉。
(l)①注意焦炭过量生成CO,反应物为硫酸钡与焦炭,产物为BaS与CO,化学方程式为:BaSO4+4C ![]() BaS+4CO↑。答案为:BaSO4+4C
BaS+4CO↑。答案为:BaSO4+4C ![]() BaS+4CO↑
BaS+4CO↑
②CO与水蒸气反应生成CO2与H2:CO+H2O![]() CO2+H2,提纯该清洁能源气体需除去CO2和H2O,所以,应将所得气体依次通入NaOH溶液和浓硫酸(或其它合理答案)。
CO2+H2,提纯该清洁能源气体需除去CO2和H2O,所以,应将所得气体依次通入NaOH溶液和浓硫酸(或其它合理答案)。
答案为:将所得气体依次通入NaOH溶液和浓硫酸(或其它合理答案)
(2)“还原料”中有BaS,臭鸡蛋气味的气体为H2S,应有酸性物质参与反应,根据所处环境判断应该是CO2,所以反应为:BaS+H2O+CO2 = BaCO3+H2S,生成BaCO3使水溶性变差。答案为:BaS+H2O+CO2 = BaCO3+H2S
(3)沉淀器中反应生成BaSO4·ZnS,硫化钡与硫酸锌为可溶性强电解质,写成离子形式,产物为沉淀,不可拆开,所以离子方程式为:S2-+Ba2++Zn2++SO42- = BaSO4·ZnS↓,答案为:S2-+Ba2++Zn2++SO42- = BaSO4·ZnS↓
(4)碘单质与硫离子的反应为:S2-+I2 = S+2I-。根据反应:![]() ,可求得过量的I2为:8.00×10-3L×0.l0 mol/L÷2=4.00×10-4 mol,则反应S2-+I2 = S+2I-中消耗的I2为:25.00×10-3 L×0.10 mol/L-4.00 ×10-4 mol=2.1×10-3 mol,根据方程式可知,S2-的物质的量亦为2.1×10-3 mol,则样品中硫离子含量为:
,可求得过量的I2为:8.00×10-3L×0.l0 mol/L÷2=4.00×10-4 mol,则反应S2-+I2 = S+2I-中消耗的I2为:25.00×10-3 L×0.10 mol/L-4.00 ×10-4 mol=2.1×10-3 mol,根据方程式可知,S2-的物质的量亦为2.1×10-3 mol,则样品中硫离子含量为:![]() 。
。
答案为:9.5%

 阅读快车系列答案
阅读快车系列答案【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323K,NaClO2溶液浓度为5×10-3molL-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO | SO | NO | NO | Cl- |
c/(molL-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___。增加压强,NO的转化率___(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___ (填“增大”、“不变”或“减小”)。
③由实验结果可知,脱硫反应速率脱硝反应速率___ (填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___ (填“增大”、“不变”或“减小”)。
②反应ClO![]() +2SO
+2SO![]() =2SO
=2SO![]() +Cl-的平衡常数K表达式为___。
+Cl-的平衡常数K表达式为___。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。