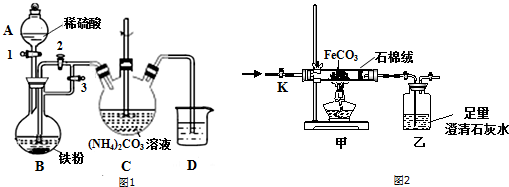
题目内容
4.表是元素周期表的一部分,回答下列有关问题: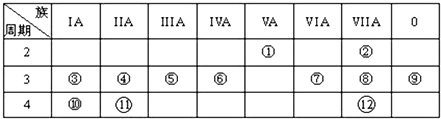
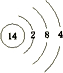
(1)画出⑥的原子结构示意图:
 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式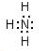 .
.(2)元素④、⑩、⑪的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为HF>HCl>H2S(均用化学式填空).
(3)③与氧形成的化合物R2O2中所含化学键类型为离子键、共价键.
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入A的最简单气态氢化物,向Y极通入O2,请写出电极反应式:
负极CH4-8e-+10OH-=CO32-+7H2O 正极O2+2H2O+4e-=4OH-.
分析 由元素在周期表的位置可知,从①开始元素分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,
(1)⑥为Si,原子序数为14;①的气态氢化物为氨气;
(2)金属性越强,最高价氧化物水化物的碱性越强;非金属性越强,最高价氧化物水化物的酸性越强;
(3)③与氧形成的化合物Na2O2;
(4)与①和⑥都相邻的一种元素A为C,A的最简单气态氢化物为甲烷,向Y极通入O2,可知甲烷在负极失去电子,氧气在正极得到电子.
解答 解:由元素在周期表的位置可知,从①开始元素分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,
(1)⑥为Si,原子序数为14,原子结构式为 ;①的气态氢化物为氨气,其电子式为
;①的气态氢化物为氨气,其电子式为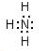 ,
,
故答案为: ;
;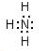 ;
;
(2)金属性越强,最高价氧化物水化物的碱性越强;非金属性越强,最高价氧化物水化物的酸性越强,则元素④、⑩、⑪的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为HF>HCl>H2S,
故答案为:KOH;HF>HCl>H2S;
(3)③与氧形成的化合物Na2O2,含离子键和共价键,故答案为:离子键、共价键;
(4)与①和⑥都相邻的一种元素A为C,A的最简单气态氢化物为甲烷,向Y极通入O2,可知甲烷在负极失去电子,氧气在正极得到电子,则负极反应为CH4-8e-+10OH-=CO32-+7H2O,正极反应为O2+2H2O+4e-=4OH-,故答案为:CH4-8e-+10OH-=CO32-+7H2O;O2+2H2O+4e-=4OH-.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意原电池电极反应的书写,题目难度不大.

练习册系列答案
相关题目
14.下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
| A. | 甲烷和氯气混合后光照发生反应 | B. | 乙炔和氯气的加成反应 | ||
| C. | 甲苯与等物质的量的Br2发生反应 | D. | 乙烯与水的加成反应 |
19.在指定环境中可能大量共存的离子组是( )
| A. | 强碱性的溶液中,Na+、S2-、[Al(OH)4]-、SO32- | |
| B. | 酸性溶液中,Fe2+、Na+、NO3-、SO42- | |
| C. | 能与铝放出H2的溶液中、K+、Cu2+、NO3-、SO42- | |
| D. | 无色溶液中Ca2+、Cu2+、ClO-、NO3- |
16.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | CS2为V形 | B. | HCN为V形 | ||
| C. | NH${\;}_{4}^{+}$为正四面体形 | D. | PCl3为平面三角形 |
13.下列有关叙述中不正确的是( )
| A. | 只用试管和胶头滴管就可区分纯碱溶液和稀盐酸 | |
| B. | Fe(OH)3是难溶于水的碱,但能通过化合反应生成 | |
| C. | 在FeCl3溶液中加入足量Cu充分反应后,溶液中的溶质只有CuCl2 | |
| D. | 有Al2O3制取Al(OH)3的途径如下图,则X可能是NaOH,也可能是HCl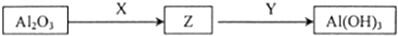 |
14.下列各组物质中,化学键类型完全相同的是( )
| A. | HI和NaI | B. | H2S和CO2 | C. | H2O2和CCl4 | D. | Na2O2和NaBr |
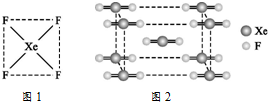 自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.