题目内容
6.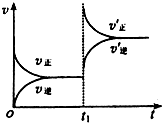 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.(1)若起始时A为l mol,反应2min达到平衡,A剩余0.4mol,则在0~2min内A的平均反应速率为0.15 mo1/(L•min)
(2)在其他条件不变的情况下,扩大容器体积,若平衡向逆反应方向移动,则a+b>c+d(选填“>”、“<”或“=”),v逆减小(选填“增大”、“减小”或“不变”)
(3)若反应速率(v)与时间(t)的关系如图所示,则导致t1时刻速率发生变化的原因可能是b.(选填编号)
a.增大A的浓度 b.缩小容器体积 c.加入催化剂 d.升高温度.
分析 (1)根据V=$\frac{△c}{△t}$计算A的平均反应速率;
(2)扩大容器体积即减小压强,反应速率减小,平衡向气体体积增大的方向移动;
(3)根据反应速率(v)与时间(t)的关系图,则t1时刻正逆反应速率都增大并且向正反应方向移动,据此分析.
解答 解:(1)若起始时A为l mol,反应2min达到平衡,A剩余0.4mol,则在0~2min内A的平均反应速率V=$\frac{△c}{△t}$=$\frac{\frac{1-0.4}{2}}{2}$=0.15mo1/(L•min),故答案为:0.15;
(2)扩大容器体积即减小压强,反应速率减小,平衡向气体体积增大的方向移动,又平衡向逆反应方向移动即为气体体积增大的方向,所以a+b>c+d,故答案为:>;减小;
(3)根据反应速率(v)与时间(t)的关系图,则t1时刻正逆反应速率都增大并且向正反应方向移动,又该反应为气体体积减小的可逆反应,所以应为升压即缩小容器体积,故选:b.
点评 本题考查化学反应速率的计算以及平衡移动的分析,题目难度不大,本题注意压强对平衡的移动原理.

练习册系列答案
相关题目
16.在一密闭容器中,反应2A(g)?2B(g)+C(?)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率降低了 | ||
| C. | C为气态 | D. | C为固态或液态 |
17.决定化学反应速率的主要因素是( )
| A. | 反应温度 | B. | 使用催化剂 | C. | 压强 | D. | 反应物性质 |
11.下列各组微粒中,核外电子总数相等的是( )
| A. | O3和CO2 | B. | OH-和Al3+ | C. | NO和CO | D. | Cl-和Ne |
18.下列各组物质中,分子数相同的一组是( )
| A. | 2LCO和2LCO2 | B. | 标准状况下22.4LH2O和1mol O2 | ||
| C. | 0,4克H2和4.48L HCl | D. | 18克水和标准状况下22.4L CO2 |
12.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
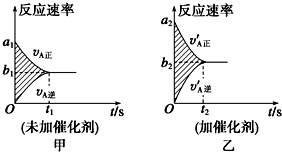
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
①30min时,反应到达平衡状态了吗?是(填“是”或“否”)简述理由从20min到30min时各物质的浓度没有发生改变
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
13.现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素的中子数为8可测定文物年代,这种同位素的符号是614C(用AZX符号表示);元素Z的离子结构示意图为 .
.
(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
