题目内容
16.工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(可供选择的试剂:稀盐酸、NaOH溶液、稀氨水,CO2等)
请写出你所设计的方案中以下各步反应涉及的化学方程式.
①Al2O3+6HCl═2AlCl3+3H2O、Fe2O3+6HCl═2Fe2Cl3+3H2O
②AlCl3+4NaOH═Na[Al(OH)4]+3NaCl、FeCl3+3NaOH═Fe(OH)3↓+3NaCl
④2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,由流程可知,
若①为盐酸时,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.②为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液.试剂③为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝;
若①为氢氧化钠时,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁.②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液.试剂③为氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,以此来解答.
解答 解:用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,由流程可知,
若①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.②为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液.试剂③为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀.加热分解得氧化铝.
①氧化铝与盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl═2AlCl3+3H2O,
氧化铁与盐酸反应生成氯化铁与水,反应方程式为 Fe2O3+6HCl═2Fe2Cl3+3H2O.
②氯化铝与氢氧化钠反应生成四羟基合铝酸钠与氯化钠,反应方程式为AlCl3+4NaOH═Na[Al(OH)4]+3NaCl,
氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,反应方程式为 FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
③四羟基合铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,反应方程式为Na〔Al(OH)4〕+CO2═Al(OH)3↓+NaHCO3,
④氢氧化铝加热分解生成氧化铝和水,反应方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3+6HCl═2AlCl3+3H2O、Fe2O3+6HCl═2Fe2Cl3+3H2O;AlCl3+4NaOH═Na[Al(OH)4]+3NaCl、FeCl3+3NaOH═Fe(OH)3↓+3NaCl;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(或若①为氢氧化钠溶液,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁.②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液.试剂③为氨水,将铝离子转化为氢氧化铝沉淀.加热分解得氧化铝.
①Al2O3+2NaOH+3H2O═2Na[Al(OH)4]、SiO2+2NaOH═Na2SiO3+H2O;
②Na[Al(OH)4]+4HCl═AlCl3+NaCl+4H2O、Na2SiO3+2HCl═H2SiO3↓+2NaCl;
③AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl;
④2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3+2NaOH+3H2O═2Na[Al(OH)4]、SiO2+2NaOH═Na2SiO3+H2O;Na[Al(OH)4]+4HCl═AlCl3+NaCl+4H2O、Na2SiO3+2HCl═H2SiO3↓+2NaCl;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.)
点评 本题考查混合物的分离提纯,为高频考点,把握氧化铝的性质、流程中的反应及混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
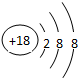 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
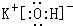 .
.(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
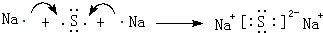 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦、①与⑥形成的化合物的电子式
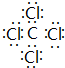 、
、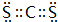 .
.(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 分别用B、C表示反应的速率,其比值是3:2 | |
| C. | 在2 min末的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 在这2 min内B和C两物质浓度都逐渐减小 |
| A. | HClO和NaOH | B. | C02和H20 | C. | NaCl和HCl | D. | KOH和KCl |
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | 2S(g)+O2(g)═2SO2(g);△H1 2S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
| A. | 化学反应必伴随能量变化 | |
| B. | 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小 | |
| C. | Ba(OH)2•8H2O和NH4Cl(固体)混合搅拌发生的是吸热反应 | |
| D. | 键能越大物质能量越高,物质越稳定 |
 E的氢化物的分子式H2O.
E的氢化物的分子式H2O. .
.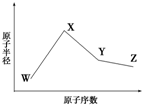 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.