题目内容
【题目】工业上可以采用热还原法制备金属镁(镁沸点为1107℃,熔点是648.8℃)。
(1)将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先升温至500℃保持一段时间,然后升温至1450℃反应制得镁。
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是。
②焦炭与碱式碳酸镁的物质的量的比值不同对镁的还原率有较大影响,结果如图。当比值大于15∶1时,还原率下降的原因可能是。
③碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学反应方程式。

(2)工业上可以采用MgCl2溶液和Na2CO3溶液混合制备碱式碳酸镁,写出反应离子方程式。反应采用68℃,温度不宜高于68℃的原因是。
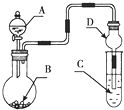
(3)工业采用电解MgCl2溶液产生Mg(OH)2 , 如图。然后用Mg(OH)2悬浊液吸收烟气中的二氧化碳,减少二氧化碳的排放同时产生碱式碳酸镁。该电池的阴极电极反应式为。电解时还得到副产物为。
【答案】
(1)在空气中镁被氧气氧化;过量的焦炭能吸附镁蒸气,收集到的镁量减少;MgO+C = Mg+CO
(2)5Mg2++5CO32-+ H2O = 4MgCO3·Mg(OH)2↓+ CO2↑;碱式碳酸镁受热分解或水解为氢氧化镁
(3)Mg2++ 2H2O +2e- = Mg(OH)2↓+H2↑;HCl
【解析】解:(1)①金属镁性质活泼,在空气中能与氧气和氛气等反应,所以要排除空气反应,②当比值大于15 :1时就是焦炭过量,焦炭具有较大的表面积具有吸附作用,能吸附镁蒸气导致镁的产率降低;③根据图中数据确定分解的最终产物为氧化镁(5×40/484=0.41),因为焦炭过量,所以产物为镁和CO;(2)该反应为镁离子部分水解得到的产物: 5Mg2++5CO32-+ H2O = 4MgCO3·Mg(OH)2↓+ CO2↑;碱式碳酸镁受热分解为氧化镁或水解为氢氧化镁进一步分解为氧化镁;(3)电解时阴极阳离子放电,应为氢离子放电产生氢气,溶液中生成的氢氧根离子与镁离子反应生成氢氧化镁沉淀,阳极上氢气放电产生氢离子,氯离子通过阴离子交换膜进入阳极区,得到盐酸副产品。

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案