题目内容
【题目】图为实验室制取和收集纯净干燥的氯气,并进行氯气的性质实验的装置图: 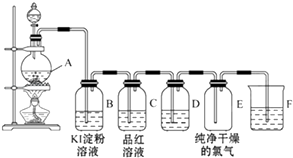
(1)反应前,在装置A中装浓盐酸(填写仪器名称)装MnO2(填写仪器名称)装置A中反应的化学方程式为 .
(2)装置B中的现象是反应的化学方程式为 .
(3)装置D中所装试剂是 , 作用是
(4)装置F中发生反应的化学方程式为
【答案】
(1)分液漏斗;圆底烧瓶;MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)溶液变蓝;Cl2+2KI=2KCl+I2
(3)浓硫酸;吸收水分(干燥气体)
(4)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】解:(1)由装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中;浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,反应化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
所以答案是:分液漏斗;圆底烧瓶;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)氯气有氧化性,能置换出碘化钾中的碘,碘单质遇到淀粉变蓝;发生的化学方程式为:Cl2+2KI=2KCl+I2 ,
MnCl2+Cl2↑+2H2O;(2)氯气有氧化性,能置换出碘化钾中的碘,碘单质遇到淀粉变蓝;发生的化学方程式为:Cl2+2KI=2KCl+I2 ,
所以答案是:溶液变蓝;Cl2+2KI=2KCl+I2;(3)浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,所以答案是:浓硫酸;吸收水分(干燥气体);(4)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气,反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,所以答案是:2NaOH+Cl2 =NaCl+NaClO+H2O.
【考点精析】掌握氯气的化学性质和氯气的实验室制法是解答本题的根本,需要知道氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.