题目内容
16.下列分子或离子在指定的分散系中一定能大量共存的一组是( )| A. | 常温下水电离出的c(H+)•c(OH-)=1×10-20的溶液:Na+、Cl-、S2-、SO32- | |
| B. | 空气:C2H2、CO2、SO2、NO | |
| C. | 含Al3+的无色溶液:Na+、SO42-、K+、ClO-、HCO3- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、NO3- |
分析 A.常温下水电离出的c(H+)•c(OH-)=1×10-20的溶液中存在大量氢离子或氢氧根离子,硫离子、亚硫酸根离子与氢离子反应;
B.一氧化氮与空气中氧气反应生成二氧化氮;
C.铝离子与次氯酸根离子、碳酸氢根离子发生双水解反应;
D.四种离子之间不反应,都不与高锰酸钾溶液反应.
解答 解:A.该溶液为酸性或碱性溶液,S2-、SO32-都与氢离子反应,在酸性溶液中不能大量共存,故A错误;
B.NO与空气中氧气反应,在空气中不能大量共存,故B错误;
C.Al3+与ClO-、HCO3-发生双水解反应,在溶液中不能大量共存,故C错误;
D.H+、Na+、SO42-、NO3-之间不发生反应,都不与高锰酸钾溶液反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
6.下列物质不属于既能跟盐酸反应又能跟NaOH溶液反应的是( )
| A. | Al | B. | Al2O3 | C. | Na2CO3 | D. | NaHCO3 |
7.铁及其化合物与生产、生活关系密切.

(1)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
①该电化腐蚀的类型为吸氧腐蚀.
②图中A、B、C三点附近的区域内,腐蚀最严重的是B(填字母).
(2)已知Fe3+、Fe2+、Cu2+在溶液中沉淀的pH如下表:
印刷电路铜板腐蚀剂常用FeCl3,腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol.L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①通入足量氯气;②加入CuO调节溶液的pH至3.2-4.7;③过滤.(提供的药品:Cl2、浓H2S04、NaOH溶液、CuO、Cu)
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如图2:
①向Fe(NO3)2溶液中加入稀盐酸,溶液颜色由浅绿色变为棕黄色,该反应的原理为3Fe2++4H++NO3-=3Fe2++NO↑+2H2O(用离子方程式表示).
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O═2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,结合流程写出该反应的化学方程式为4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O.
(4)某铁质容器材料为碳素钢,可盛装冷浓硫酸.取5.60g该材料放人15.0mL浓硫酸中加热,充分反应后得到溶液X并收集到气体Y.
①甲组通过实验确定了X中含有Fe3+,为检验X中是否还含有Fe2+,可另取X溶液加入BD(填序号).
A.KSCN溶液和氯水 B.K3[Fe(CN)6]溶液
C.NaOH溶液 D.酸性KMnO4溶液
②为分析气体Y中的成分,乙组将560mL(标准状况)气体Y通入足量溴水,然后向该溶液中加入足量BaCl2溶液,过滤、洗涤、干燥后,称得沉淀质量为2.33g.则气体Y通入足量溴水反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,参加该反应的气体在Y中的体积分数为40%.

(1)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
①该电化腐蚀的类型为吸氧腐蚀.
②图中A、B、C三点附近的区域内,腐蚀最严重的是B(填字母).
(2)已知Fe3+、Fe2+、Cu2+在溶液中沉淀的pH如下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如图2:
①向Fe(NO3)2溶液中加入稀盐酸,溶液颜色由浅绿色变为棕黄色,该反应的原理为3Fe2++4H++NO3-=3Fe2++NO↑+2H2O(用离子方程式表示).
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O═2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,结合流程写出该反应的化学方程式为4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O.
(4)某铁质容器材料为碳素钢,可盛装冷浓硫酸.取5.60g该材料放人15.0mL浓硫酸中加热,充分反应后得到溶液X并收集到气体Y.
①甲组通过实验确定了X中含有Fe3+,为检验X中是否还含有Fe2+,可另取X溶液加入BD(填序号).
A.KSCN溶液和氯水 B.K3[Fe(CN)6]溶液
C.NaOH溶液 D.酸性KMnO4溶液
②为分析气体Y中的成分,乙组将560mL(标准状况)气体Y通入足量溴水,然后向该溶液中加入足量BaCl2溶液,过滤、洗涤、干燥后,称得沉淀质量为2.33g.则气体Y通入足量溴水反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,参加该反应的气体在Y中的体积分数为40%.
11.关于如图所示化合物的说法正确的是( )
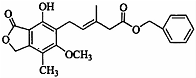

| A. | 分子中所有的原子共平面 | |
| B. | 既可以与FeCl3溶液发生显色反应.又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 1 mol该化合物最多可以与9mol H2发生加成反应 | |
| D. | 该物质能发生取代反应、氧化反应、加成反应 |
8.分子式为C6H14的烷烃在结构式中含有3个甲基的同分异构体有多少( )
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
5.下列实验操作中正确的是( )
①蒸馏时,使温度计水银球插入蒸馏烧瓶液体中
②测溶液pH时,用玻璃棒蘸取溶液点滴到放在表面皿上的pH试纸上
③制取乙酸乙酯时,把乙酸和乙醇依次加入浓硫酸中
④加热蒸馏烧瓶中的液体时,为防止暴沸,向瓶中加入碎瓷片
⑤滴定管洗净后经蒸馏水润洗,马上注入标准液进行滴定
⑥加热坩埚中的硫酸铜晶体,失水后在空气中冷却,再称量
⑦分液时,分液漏斗里的下层液体从下口放出,上层液体从上口倒出.
①蒸馏时,使温度计水银球插入蒸馏烧瓶液体中
②测溶液pH时,用玻璃棒蘸取溶液点滴到放在表面皿上的pH试纸上
③制取乙酸乙酯时,把乙酸和乙醇依次加入浓硫酸中
④加热蒸馏烧瓶中的液体时,为防止暴沸,向瓶中加入碎瓷片
⑤滴定管洗净后经蒸馏水润洗,马上注入标准液进行滴定
⑥加热坩埚中的硫酸铜晶体,失水后在空气中冷却,再称量
⑦分液时,分液漏斗里的下层液体从下口放出,上层液体从上口倒出.
| A. | 除①③⑤ | B. | 除③⑤⑥ | C. | ②④⑦ | D. | ①②④⑦ |
6.下列说法中,正确的是( )
| A. | 在25℃101KPa下,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| B. | 表示中和热的化学方程式:H++OH-=H2O△H=-57.3kJ•mol-1 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的正极相连,负极连接到一块废铁上可防止闸被腐蚀 | |
| D. | 已知热化学方程式:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1 S(g)+O2(g)=SO2(g)△H=ba kJ•mol-1 则b>a |

 .
. 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出4.0g固体,配成1L溶液,请计算:
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出4.0g固体,配成1L溶液,请计算: