题目内容
3.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)?2NH3(g),一种工业合成氨,进而合成尿素的简易流程图如下: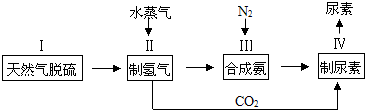
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓
(2)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O.氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)则该燃料电池的负极反应式是2NH3+6OH--6e-=N2+6H2O.
(3)已知尿素的结构简式为
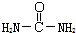 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
分析 (1)根据元素守恒和电子得失守恒写出化学方程式;
(2)根据元素守恒及题中的反应物和生成物写出化学方程式;原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水;
(3)尿素中含有C、H、O、N四种元素,形成有离子键的物质,则有铵根离子,根据同分异构体的特点写出有关化学式.
解答 解:(1)根据元素守恒及题中的反应物和生成物可知化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓,
故答案为:2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓;
(2)根据元素守恒及题中的反应物和生成物写出化学方程式为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O;
原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为:2NH3+6OH--6e-=N2+6H2O,
故答案为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O;2NH3+6OH--6e-=N2+6H2O;
(3)尿素中含有CHON四种元素,形成有离子键的物质,应该含有铵根离子,则满足条件的尿素的同分异构体为:NH4OCN,
故答案为:NH4OCN.
点评 本题考查了原电池原理、化学方程式书写、同分异构体书写等知识,题目难度中等,注意掌握化学方程式、电极反应式的书写原则,明确同分异构体的书写方法.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
13.为了检验某FeCl2溶液是否变质,应选用的试剂是( )
| A. | 稀盐酸 | B. | KSCN溶液 | C. | 铁粉 | D. | 石蕊试液 |
14.下列关于金属钠的说法中,正确的是( )
| A. | 钠与氧气反应的产物与反应条件无关 | |
| B. | 钠在反应中易失电子,表现出还原性 | |
| C. | 钠在氯气中燃烧产生红色火焰 | |
| D. | 钠只有在加热条件下才能与氯气发生反应 |
11.下列关于物质的分类中正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 氯化银 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化 铁胶体 | 胆矾 | 次氯酸 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
18.下列金属冶炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$ 2Na+Cl2↑ | B. | MgO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$ 3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2 |
8.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如图:
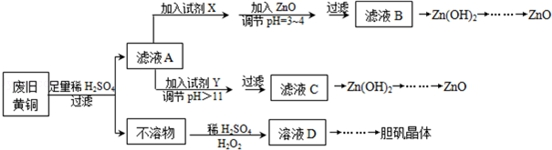
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)试剂X可能是H2O2,其作用是将Fe2+氧化为Fe3+.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为97.00%.
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会偏高(填“偏高”、“偏低”或“不变”).

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)试剂X可能是H2O2,其作用是将Fe2+氧化为Fe3+.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为97.00%.
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会偏高(填“偏高”、“偏低”或“不变”).
15.下列离子方程式正确的是( )
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | 氯化铁溶液和铜反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 石灰水与碳酸氢钠溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
12.下列叙说正确的是( )
| A. | 同温同压下,若物质物质的量相等,其体积一定相等 | |
| B. | 1升氮气比1升氧气的质量小 | |
| C. | 等体积的二氧化碳和一氧化碳所含分子数一定相等 | |
| D. | 相同条件下的一氧化碳和氮气,若体积相等,则质量一定相等 |
13.已知25℃、101kPa条件下:
(1)4Al(s)+3O2(g)═2Al2O3(s)△H=-2 834.9kJ•mol-1
(2)4Al(s)+2O3(g)═2Al2O3(s)△H=-3 119.1kJ•mol-1
由此得出的正确结论是( )
(1)4Al(s)+3O2(g)═2Al2O3(s)△H=-2 834.9kJ•mol-1
(2)4Al(s)+2O3(g)═2Al2O3(s)△H=-3 119.1kJ•mol-1
由此得出的正确结论是( )
| A. | O2比O3稳定,由O2变O3为放热反应 | |
| B. | O3比O2稳定,由O2变O3为吸热反应 | |
| C. | 等质量的O2比O3能量低,由O2变O3为吸热反应 | |
| D. | 等质量的O2比O3能量高,由O2变O3为放热反应 |