题目内容
19.下列说法正确的是( )| A. | π键是由两个p轨道“头碰头”重叠形成的 | |
| B. | σ键就是单键,π键就是双键 | |
| C. | 乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键 | |
| D. | H2分子中含σ键,而Cl2分子中含π键 |
分析 σ键是“头碰头”重叠形成,可沿键轴自由旋转,为轴对称;而π键是由两个p电子“肩并肩”重叠形成,重叠程度小,为镜像对称,以此来解答.
解答 解:A.π键是由两个p电子“肩并肩”重叠形成,σ键是“头碰头”重叠形成,故A错误;
B、双键和叁键中都有σ键和π键,所以不能说成σ键就是单键,π键就是双键,故B错误;
C.乙烷分子中均为单键,乙烯中含C=C键,有1个π键,则乙烷分子中的键全为σ键而乙烯分子中含σ键和π键,故C正确;
D.H2和Cl2分子中只含单键,只有σ键,故D错误;
故选C.
点评 本题考查共价键的类型,明确σ键和π键的形成即可解答,题目难度不大,注重基础知识的考查.

练习册系列答案
相关题目
9.在0.1mol/L的CH3 COOH溶液中存在如下电离平衡:CH3 COOH?CH3 COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+ )减少 | |
| D. | 加入少量CH3 C OONa固体,平衡向正反应方向移动 |
10.室温下,关于1.0mL 0.l mol/L氨水,下列判断正确的是( )
| A. | 溶液的pH等于13 | |
| B. | 加入少量NH4Cl固体,c(OH-)不变 | |
| C. | c(OH-)=c(NH4+)+c(H+) | |
| D. | 与1.0 mL 0.l mol/L盐酸混合后,溶液呈中性 |
7.密闭容器中分别盛有以下各选项的物质,其中一定为纯净物的是( )
| A. | 二氟甲烷 | B. | 二溴乙烷 | C. | 二甲基苯 | D. | 2-丁烯 |
14.实验室用如图所示装置制备氯气并进行性质实验(必要时可加热,省略夹持装置).
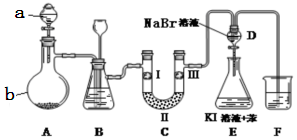
(1)仪器a的名称是:分液漏斗;装置B中长颈漏斗的作用是:平衡装置中压强,防止玻璃仪器破裂.蒸馏烧瓶b中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)洗气装置B试剂是饱和食盐水,其作用是除去氯气中的氯化氢气体,分液漏斗D中发生反应的化学方程式为Cl2+2NaBr=Br2+2NaCl.
(3)装置C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,设计C装置的目的是验证氯气还是次氯酸具有漂白性.
(4)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验结束后将产生的氯气通入含紫色石蕊溶液的试管里,请填写表中的空白:

(1)仪器a的名称是:分液漏斗;装置B中长颈漏斗的作用是:平衡装置中压强,防止玻璃仪器破裂.蒸馏烧瓶b中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)洗气装置B试剂是饱和食盐水,其作用是除去氯气中的氯化氢气体,分液漏斗D中发生反应的化学方程式为Cl2+2NaBr=Br2+2NaCl.
(3)装置C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,设计C装置的目的是验证氯气还是次氯酸具有漂白性.
(4)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验结束后将产生的氯气通入含紫色石蕊溶液的试管里,请填写表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
4.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 H2S | B. | C2H4 BF3 | C. | C60 C2H4 | D. | NH3 HCl |
11.向含有物质的量均为0.01mol的NaOH和 Na2CO3的混合溶液中逐滴滴加a L 0.01mol•L-1的稀盐酸.下列说法不正确的是( )
| A. | 当a=1时,发生的离子反应为:OH-+H+═H2O | |
| B. | 当a=2时,发生的离子反应为:OH-+CO32-+2H+═HCO3-+H2O | |
| C. | 当1<a<2,反应后的溶液中CO32-和HCO3-的物质的量之比为:(a×10-2-0.01):(0.02-a×10-2) | |
| D. | 当a≥3时,发生的离子反应:3H++OHˉ+CO32-═2H2O+CO2↑ |
8.镁在CO2含量较多的空气里燃烧的产物是( )
| A. | MgO | B. | MgO和C | C. | MgO、Mg3N2 | D. | MgO、Mg3N2 和C |