题目内容
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48L(标准状况),向所得溶液中加入物质的量浓度为3mol?L-1的NaOH溶液至沉淀完全.则下列有关叙述中不正确的是( )
| A、开始加入合金的物质的量之和为0.3mol |
| B、反应中被还原和未被还原的硝酸物质的量之比为3:1 |
| C、沉淀完全时消耗NaOH溶液的体积为200mL |
| D、生成沉淀的质量比原合金的质量增加10.2g |
考点:有关混合物反应的计算
专题:计算题
分析:将一定量的镁和铜组成的混合物加入到稀HNO3中,两者恰好完全反应,反应方程式为:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,标准状况下4.48LNO的物质的量为:n(NO)=
=0.2mol,
A.由HNO3生成0.2molNO得到电子的物质的量为:0.2mol×(5-2)=0.6mol,铜、镁都是2价金属,根据电子守恒,可以计算出参加反应的金属的物质的量;
B.根据反应3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可以计算出反应中被还原和未被还原的硝酸物质的量之比;
C.根据铜离子、镁离子与氢氧化钠反应的离子方程式可以计算出消耗氢氧化钠的物质的量,然后根据V=
计算出消耗氢氧化钠溶液的体积;
D.沉淀中增加的质量为氢氧根离子的质量,根据消耗氢氧化钠的物质的量可以计算出氢氧根离子的物质的量及质量,从而得出生成沉淀质量比原合金的增加量.
| 4.48L |
| 22.4Lmol |
A.由HNO3生成0.2molNO得到电子的物质的量为:0.2mol×(5-2)=0.6mol,铜、镁都是2价金属,根据电子守恒,可以计算出参加反应的金属的物质的量;
B.根据反应3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可以计算出反应中被还原和未被还原的硝酸物质的量之比;
C.根据铜离子、镁离子与氢氧化钠反应的离子方程式可以计算出消耗氢氧化钠的物质的量,然后根据V=
| n |
| c |
D.沉淀中增加的质量为氢氧根离子的质量,根据消耗氢氧化钠的物质的量可以计算出氢氧根离子的物质的量及质量,从而得出生成沉淀质量比原合金的增加量.
解答:
解:金属与硝酸恰好反应,反应方程式为:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,标准状况下4.48LNO的物质的量为:n(NO)=
=0.2mol,
A.由HNO3生成0.2molNO得到电子的物质的量为:0.2mol×(5-2)=0.6mol,铜、镁都是2价金属,根据电子守恒,参加反应的金属的物质的量为:
=0.3mol,故A正确;
B.根据3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O两个反应可知,被还原的硝酸与未被还原的硝酸的物质的量之比为:2mol:6mol=1:3,故B错误;
C.根据反应Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,0.3mol铜离子、镁离子完全转化成沉淀,消耗氢氧化钠的物质的量为:0.3mol×2=0.6mol,消耗氢氧化钠溶液的体积为:
=0.2L=200mL,故C正确;
D.镁、铜合金变成Mg(OH)2↓、Cu(OH)2↓沉淀,沉淀中增加的质量为氢氧根离子的质量,生成沉淀消耗了0.6mol氢氧化钠,则含有氢氧根离子的质量为:17g/mol×0.6mol=10.2g,即:生成沉淀的质量比原合金的质量增加10.2g,故D正确;
故选B.
| 4.48L |
| 22.4Lmol |
A.由HNO3生成0.2molNO得到电子的物质的量为:0.2mol×(5-2)=0.6mol,铜、镁都是2价金属,根据电子守恒,参加反应的金属的物质的量为:
| 0.6mol |
| 2 |
B.根据3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O两个反应可知,被还原的硝酸与未被还原的硝酸的物质的量之比为:2mol:6mol=1:3,故B错误;
C.根据反应Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,0.3mol铜离子、镁离子完全转化成沉淀,消耗氢氧化钠的物质的量为:0.3mol×2=0.6mol,消耗氢氧化钠溶液的体积为:
| 0.6mol |
| 3mol/L |
D.镁、铜合金变成Mg(OH)2↓、Cu(OH)2↓沉淀,沉淀中增加的质量为氢氧根离子的质量,生成沉淀消耗了0.6mol氢氧化钠,则含有氢氧根离子的质量为:17g/mol×0.6mol=10.2g,即:生成沉淀的质量比原合金的质量增加10.2g,故D正确;
故选B.
点评:本题主要考查混合物有关计算,题目难度中等,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道综合性较强、质量较好的题.

练习册系列答案
相关题目
在浓度均为3mol/L的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体质量之比为3:4.则加入铁粉的质量是( )
| A、11.2 g |
| B、8.4 g |
| C、5.6 g |
| D、1.8 g |
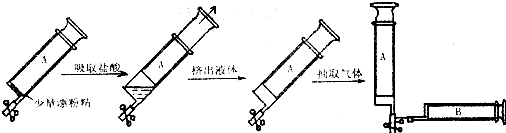
 图中的实验装置可用于制取乙炔.
图中的实验装置可用于制取乙炔. 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整. 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: