题目内容
7.氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:①2Al2O3(s)?4Al(g)+3O2(g)
②2C(s)+O2(g)?2CO(g)
③2Al(g)+N2(g)?2AlN(s)
(1)断开N2分子内的共价键要吸收热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响反应②消耗O2会使反应①的平衡右移,使Al(g)浓度增大,反应③的平衡右移,提高AlN的产率.
(3)Al2O3、C、N2合成AlN的平衡常数表达式K=$\frac{{c}^{3}(CO)}{c({N}_{2})}$.
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):

①AlN与NaOH溶液反应产生NH3的化学方程式是AlN+H2O+NaOH=NaAlO2+NH3↑
②锥形瓶内吸收NH3的离子方程式是NH3+H+=NH4+
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液,用红色石蕊试纸检验,观察试纸是否变蓝色(将检验过程补充完整).
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c(NaOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为V(NaOH)mL.下面有关计算正确的是B.
A.样品中AlN的质量:41×V(NaOH).c(NaOH)×10-3
B.AlN的质量分数:$\frac{41×[2V({H}_{2}S{O}_{4})c({H}_{2}S{O}_{4})-V(NaOH).c(NaOH)]×1{0}^{-3}}{m}$×100
C.锥形瓶吸收NH3的物质的量:[V(H2SO4).c(H2SO4)-v(NaOH).c(NaOH)×10?????????
分析 (1)化学键断裂需要吸收能量;
(2)浓度对化学平衡的影响是,增大反应物浓度或减小生成物浓度平衡正向进行,增大生成物浓度或减小反应物浓度,平衡逆向进行;所以反应②对于反应①③来说都是增大反应物浓度,平衡正向进行提高AlN的产率;
(3)先书写此反应的化学方程式,Al2O3+3C+N2=2AlN+3CO,反应中的纯液体和固体不能列入表达式;
(4)①AlN与NaOH溶液反应生成偏铝酸钠和氨气;
②锥形瓶内吸收NH3的反应是硫酸和氨气反应生成硫酸铵,据此书写离子方程式;
③取少量蒸馏出的溶液,利用氨水溶液显碱性检验,可以利用红色石蕊试纸检验,观察试纸是否变蓝检验,或利用酚酞溶液观察溶液是否变红色;
④氢氧化钠溶液滴定时依据化学反应的定量关系计算,根据锥形瓶中总的硫酸物质的量计算出AlN的量,m(Al)=[2c(H2SO4)•v(H2SO4)-c(NaOH)•V(NaOH)]×10-3×41;
解答 解:(1)化学键断裂需要吸收能量,形成化学键放出热量,断开N2分子内的共价键要吸收热量;
故答案为:吸收;
(2)浓度对化学平衡的影响是,增大反应物浓度或减小生成物浓度平衡正向进行,增大生成物浓度或减小反应物浓度,平衡逆向进行,反应②消耗O2会使反应①的平衡右移,使Al(g)浓度增大,反应③的平衡右移,提高AlN的产率,所以反应②对于反应①③来说都是增大反应物浓度,平衡正向进行提高AlN的产率;
故答案为:反应②消耗O2使反应①的平衡右移,使Al(g)浓度增大,反应③的平衡右移,提高AlN的产率;
(3)Al2O3、C、N2合成AlN的反应的化学方程式为,Al2O3+3C+N2=2AlN+3CO,反应中的纯液体和固体不能列入表达式,此反应的平衡常数K=$\frac{{c}^{3}(CO)}{c({N}_{2})}$;
故答案为:$\frac{{c}^{3}(CO)}{c({N}_{2})}$;
(4)①AlN与NaOH溶液反应生成偏铝酸钠和氨气,反应的化学方程式为:AlN+H2O+NaOH=NaAlO2+NH3↑;
故答案为:AlN+H2O+NaOH=NaAlO2+NH3↑;
②锥形瓶内吸收NH3的反应是硫酸和氨气反应生成硫酸铵,据此书写离子方程式为:NH3+H+=NH4+;
故答案为:NH3+H+=NH4+;
③检验NH3是否完全蒸出的方法是,取少量蒸馏出的溶液,利用氨水溶液显碱性检验,可以利用红色石蕊试纸检验,观察试纸是否变蓝检验,若不变蓝色说明完全蒸出,或利用酚酞溶液观察溶液是否变红色,不变红色证明NH3是完全蒸出;
故答案为:用红色石蕊试纸检验,观察试纸是否变蓝色;
④A、氢氧化钠溶液消耗的量是中和剩余硫酸的量,故A错误;
B、硫酸和NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c(NaOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为V(NaOH)mL,氢氧化钠溶液滴定时依据化学反应的定量关系计算,AlN+H2O+NaOH=NaAlO2+NH3↑;根据锥形瓶中总的硫酸物质的量计算出AlN的量,m(AlN)=[2c(H2SO4)•v(H2SO4)-c(NaOH)•V(NaOH)]×10-3×41,质量分数=$\frac{41×[2c({H}_{2}S{O}_{4})V({H}_{2}S{O}_{4})-c(NaOH)V(NaOH)]}{m}$×10-3×100%,故B正确;
C、锥形瓶吸收NH3的物质的量:[2V(H2SO4).c(H2SO4)-v(NaOH).c(NaOH)]×10-3?,故C错误;故答案为:B.
点评 本题以AlN的制备的工业流程为载体,考查了反应热、化学平衡、陌生化学方程式书写、物质的检验、有关滴定实验的计算等内容,综合性强,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
| A. | 乙烯属于不饱和烃,乙烷属于饱和烃 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不在同一平面上 | |
| C. | 乙烯和乙烷燃烧现象相同,完全燃烧产物也相同 | |
| D. | 乙烯能使酸性高锰酸钾溶液褪色,乙烷不能 |
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | W不能与同族元素形成离子化合物 |
| A. | 丙烯 | B. | 乙炔 | C. | 甲苯 | D. | 甲烷 |
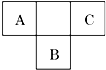 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.