题目内容
19.氯化铬酰(CrO3Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题.(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号).
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性分子(填“极性”或“非极性”).
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线形,易溶于水的有②③(填序号)
分析 (1)Cr的原子序数为24,根据能量最低原理书写基态原子的电子排布式,根据最外层电子数为1判断;
(2)根据相似相溶判断分子的极性;
(3)当中心原子形成3个δ键(含孤对电子),应为sp2杂化;结合加成电子对互斥模型判断CS2的空间构型;根据相似相溶规律可知CH3OH、HCHO易溶于水.
解答 解:(1)Cr的原子序数为24,根据能量最低原理可知基态原子的电子排布式为1s22s22p63s23p63d54s1,
铬原子的最外层电子数为1,位于第四周期,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu,
故答案为:1s22s22p63s23p63d54s1; K、Cu;
(2)CCl4、CS2等为非极性分子,CrO2Cl2能与CCl4、CS2等互溶,根据相似相溶可知,CrO2Cl2为非极性分子,故答案为:非极性;
(3)①苯中碳原子采取sp2杂化;②CH3OH中碳原子采取sp3杂化;③HCHO中碳原子采取sp2杂化;④CS2中碳原子采取sp杂化;⑤CCl4中碳原子采取sp3杂化,所以碳原子采取sp2杂化的分子有①③;CS2中碳原子采取sp杂化,且没有孤对电子,应为直线形分子,CH3OH、HCHO均为极性分子而溶剂水也为极性分子,根据相似相溶规律可知CH3OH、HCHO易溶于水,故答案为:①③;直线形;②③;
点评 本题考查较为综合,涉及电子排布式、分子的极性、杂化类型等知识,题目难度较大,注意相似相溶原理的应用.

练习册系列答案
相关题目
9.“保护环境,就是保护自己.”目前,我国城市环境中主要的大气污染物是( )
| A. | HCl、NO2、N2、粉尘 | B. | CO2、Cl2、N2、雾 | C. | SO2、NO2、CO、烟尘 | D. | CO2、NO、NH3、H2S |
10.甲、乙两烧杯中盛有物质的量浓度相等的盐酸、氢氧化钠溶液各1L,分别向其中加入等质量的铝片,反应完全后,甲中产生H2的体积为2.24L,乙中产生H2的体积为3.36L(气体体积均在标准状况下测定),则下列判断正确的是( )
| A. | 甲、乙中铝都有剩余 | |
| B. | 铝片的质量是5.4 g | |
| C. | 盐酸或氢氧化钠的物质的量浓度为0.1 mol/L | |
| D. | 盐酸或氢氧化钠的物质的量浓度为0.2 mol/L |
14.柠檬烯是一种食用香料,其结构为;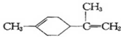 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 柠檬烯的一氯代物有9种 | |
| B. | 柠檬烯和丁基苯(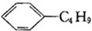 )互为同分异构体 )互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化等反应 |
4.下列叙述正确的是( )
| A. | 欲配制质量分数为10%的ZnSO4溶液,将10g ZnSO4•7H2O溶解在90g水中 | |
| B. | 常温常压下,22.4L的NO2气体含有1.81×1024个原子 | |
| C. | 为鉴别KCl、AlCl3和MgCl2溶液,各取少量分别向三种溶液中滴加NaOH溶液至过量 | |
| D. | 某溶液中加入盐酸能产生使石灰水变浑浊的气体,则该溶液中一定含有CO32- |
11.下列关于碱金属的叙述中,正确的是( )
| A. | 金属钠着火时,可用水或泡沫灭火器灭火 | |
| B. | 碱金属单质都可保存在煤油中 | |
| C. | 钠离子核外电子数比钠原子核外电子数少 | |
| D. | 碱金属中密度最小,熔、沸点最高的是铯 |

