题目内容
18.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
分析 aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),原子序数:b>a>c>d,A、B同周期,C、D同周期,且A、B在周期表中C、D的下一周期,由形成的离子可知,A、B为金属,C、D为非金属性,结合元素周期律递变规律解答该题.
解答 解:aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),原子序数:b>a>c>d,A、B同周期,C、D同周期,且A、B在周期表中C、D的下一周期,由形成的离子可知,A、B为金属,C、D为非金属性,
A.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故A正确;
B.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故B错误;
C.A、B为金属,原子序数:b>a,金属性:A>B,而C、D为非金属,原子序数c>d,非金属性C>D,故C错误;
D.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故D错误,
故选A.
点评 本题考查位置结构性质关系及应用,关键是根据核外电子排布确定元素所在周期表中的位置,在根据元素周期律的递变规律是解答,难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
8.某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是试管.
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液.
实验记录(划斜线部分不必填写):
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性.
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化在亚铁盐溶液中加入少量铁单质,并简述Fe2+的检验的方法取少量亚铁盐溶液加入几滴KSCN溶液无明显现象,通入氯水后溶液呈血红色.
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是试管.
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液.
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe3+具有氧化性 |
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化在亚铁盐溶液中加入少量铁单质,并简述Fe2+的检验的方法取少量亚铁盐溶液加入几滴KSCN溶液无明显现象,通入氯水后溶液呈血红色.
9.“保护环境,就是保护自己.”目前,我国城市环境中主要的大气污染物是( )
| A. | HCl、NO2、N2、粉尘 | B. | CO2、Cl2、N2、雾 | C. | SO2、NO2、CO、烟尘 | D. | CO2、NO、NH3、H2S |
6.A、B为两短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为( )
| A. | A2B3 | B. | BA2 | C. | AB4 | D. | B3A2 |
13.一些中草药中常存在下列四种香豆素类化合物,有关说法正确的是( )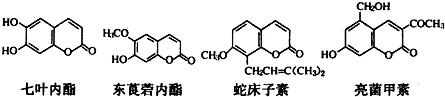

| A. | 七叶内酯与东茛菪内酯互为同系物 | |
| B. | 四种化合物含有的官能团种类完全相同 | |
| C. | l mol上述四种物质与足量氢氧化钠溶液反应,消耗氢氧化钠最多的是亮菌甲素 | |
| D. | 它们都能使溴的四氯化碳溶液褪色 |
3.在FeCl3和CuCl2的混和溶液中,加入过量Fe粉,完全反应后,余下固体的质量与所加Fe粉质量相等,则原混和液中FeCl3和CuCl2的物质的量浓度之比为( )
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
10.甲、乙两烧杯中盛有物质的量浓度相等的盐酸、氢氧化钠溶液各1L,分别向其中加入等质量的铝片,反应完全后,甲中产生H2的体积为2.24L,乙中产生H2的体积为3.36L(气体体积均在标准状况下测定),则下列判断正确的是( )
| A. | 甲、乙中铝都有剩余 | |
| B. | 铝片的质量是5.4 g | |
| C. | 盐酸或氢氧化钠的物质的量浓度为0.1 mol/L | |
| D. | 盐酸或氢氧化钠的物质的量浓度为0.2 mol/L |

