题目内容
10. 我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如下图所示,其中固体薄膜只允许Li+通过.锂离子电池的总反应为xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4,下列有关说法错误的是( )
我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如下图所示,其中固体薄膜只允许Li+通过.锂离子电池的总反应为xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4,下列有关说法错误的是( )| A. | 放电时,Li+穿过固体薄膜进入到水溶液电解质中 | |
| B. | 放电时,正极反应为Li1-xMn2O4+xLi++xe-?LiMn2O4 | |
| C. | 该电池的缺点是存在副反应:2Li+2H2O?2LiOH+H2↑ | |
| D. | 充电时,电极b为阳极,发生氧化反应 |
分析 放电时,电池反应式为xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4,负极反应式为xLi-xe-═xLi+,正极反应式为xLi++Li1-xMn2O4+xe-═LiMn2O4,充电时,阳极、阴极电极反应式与正极、负极电极反应式正好相反,以此解答该题.
解答 解:A.原电池工作时阳离子向正极移动,则放电时,Li+穿过固体薄膜进入到水溶液电解质中,故A正确;
B.正极发生还原反应,Li1-xMn2O4得电子被还原,反应为Li1-xMn2O4+xLi++xe-?LiMn2O4,故B正确;
C.锂和水不接触,不存在锂和水的反应,故C错误;
D.b为原电池正极,充电时连接电源正极,为电解池的阳极,发生氧化反应,故D正确.
故选C.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生的分析能力,明确各个电极上发生的反应是解本题关键,知道正负极与阴阳极电极反应式之间的关系,难点是电极反应式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
20.铅蓄电池放电时发生的反应是:Pb+SO42--2e-═PbSO4;PbO2+4H++SO42-+2e-═PbSO4+2H2O,使用该电池时,若外电路上转移电子0.05mol,则消耗H2SO4的质量是( )
| A. | 0.05mol | B. | 0.025mol | C. | 4.9g | D. | 9.8g |
1.下列说法正确的是( )
| A. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 0.1mol/L氨水加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(N{{H}_{3}•{H}_{2}O}_{\;})}$的值减小 | |
| C. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| D. | 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大 |
18.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷中共价键数目为4NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
5.短周期元素X、Y、Z、W的原子序数依次增大.它们的原子最外层电子数之和为13,X的原子半径比Y的小,其中X与W同主族.一种常见的无色无味液体分解可以得到X和Z元素的单质.下列说法中不正确的是( )
| A. | X、Y、Z三种元素可以形成离子化合物 | |
| B. | 元素X 和W之间不可能形成二元化合物 | |
| C. | 元素Y的简单气态氧化物的热稳定性比Z的弱 | |
| D. | 元素Y、Z、W中,元素W的简单离子的半径最小 |
15.下列操作或装置能达到实验目的是( )
| A. | 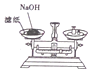 称取一定量的NaOH | |
| B. | 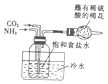 制取NaHCO3 | |
| C. | 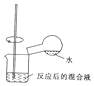 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 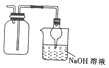 收集NO2丙防止其污染环境 |
2.以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图.下列说法正确的是( )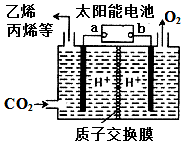

| A. | a电极为太阳能电池的正极 | |
| B. | 产生丙烯的电极反应式为:3CO2+18H++18e-═CH3CH=CH2+6H2O | |
| C. | 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散 | |
| D. | 太阳能电池的原理与原电池的原理相同 |
19.化学知识在生产和生活中有重要的应用,下列说法中不正确的是( )
| A. | 发酵粉中含有NaHCO3,能使焙制出的糕点疏松多孔 | |
| B. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 鼓励利用太阳能,风能等清洁能源,可以减少PM2.5的污染 | |
| D. | 金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
11.下列离子方程式正确的是( )
| A. | 醋酸与氢氧化钠溶液反应:OH-+H+═H2O | |
| B. | 氯气与水反应:Cl2+H2O?Cl-+HClO+H+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |