题目内容
14.美国航天局于2015年9月28日宣布,在火星表面发现溶解有高氯酸盐的液态水活动.下列有关说法一定正确的是( )| A. | 高氯酸盐和水均为强电解质 | |
| B. | 1H2O与2H2O互为同位素 | |
| C. | 高氯酸盐结构中一定含有共价键和离子键 | |
| D. | 常温下,高氯酸盐水溶液的pH=7 |
分析 A.水是部分电离的电解质,为弱电解质;
B.具有相同质子数,不同中子数的同一元素的不同核素互为同位素;
C.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
D.弱碱形成的高氯酸盐发生水解显酸性.
解答 解:A.水是部分电离的电解质,为弱电解质,故A错误;
B.1H2O与2H2O为分子,不能称之为同位素,故B错误;
C.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,则阳离子和高氯酸根离子之间存在离子键、Cl原子和O原子之间存在共价键,故C正确;
D.弱碱形成的高氯酸盐发生水解显酸性,所以常温下,高氯酸盐水溶液的pH不一定为7,故D错误;
故选C.
点评 本题考查较综合,涉及电解质强弱判断、同位素判断、化学键、盐类水解等知识点,侧重考查基本理论,注重基础知识的考查,题目难度不大.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
1.一定温度下,在体积不变的密闭容器中,对于可逆反应2HI(g)?H2(g)+I2(g)的下列叙述中,能说明反应已达到平衡的是( )
| A. | HI生成的速率与分解的速率相等 | |
| B. | 单位时间内消耗a mol H2,同时生成2a mol HI | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的物质的量不再变化 |
2.常温下,在水中加入(或通入)少量下列物质,水电离的c(H+)•c(OH-)会增大的是( )
| A. | HCl | B. | NaCl | C. | Na2CO3 | D. | Na2O2 |
2.已知1mol白磷完全转化为红磷放出29.2kJ热量,下列两个反应:P4(白,s)+5O2(g)═2P2O5(s)△H=-Q1,4P(红,s)+5O2(g)═2P2O5(s)△H=-Q2,Q1与Q2的关系是( )
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法确定 |
9.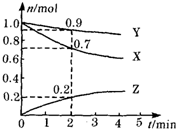 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )| A. | X+3Y=2Z 0.1mol•min-1 | B. | 2X+Y?2Z 0.1mol•min-1 | ||
| C. | X+2Y=Z 0.05mol•min-1 | D. | 3X+Y?2Z 0.05mol•min-1 |
19.“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾伤害的+6 价的铬.下列铬的化合物中铬呈+6 价的是( )
| A. | Cr2(SO4)3 | B. | Cr2O3 | C. | K2Cr2O7 | D. | Cr(OH)3 |
6.下列排列的顺序正确的是( )
| A. | 热稳定性:H2O>HF>H2S | |
| B. | 熔点:Al>K>Na | |
| C. | 碱性:Al(OH)3>Mg(OH)2>LiOH | |
| D. | 结合质子能力:CO32->CH3COO->SO42- |
3.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述中不正确的是( )
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 | |
| C. | “出汗”→变成白色固体(粉末)过程中只发生物理变化 | |
| D. | 最后变成碳酸钠粉末 |
4.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |