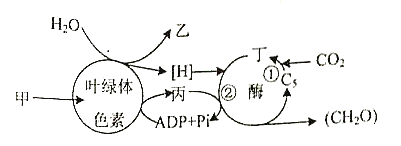
题目内容
【题目】(1)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。
【答案】CH3COOH>H2CO3>HClO b、d c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) > 1.0×10-7mol·L-1 2
【解析】
(1)①分析表格中数据可知,电离常数CH3COOH>H2CO3>HClO,由此可得出三种酸的酸性顺序。
a.K(CH3COOH)> K1(H2CO3),反应CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O能发生;
b.K(HClO)<K1(H2CO3),反应CO32-+2HClO=CO2↑+H2O+2ClO-不能发生;
c.K(CH3COOH)> K(HClO),反应ClO-+CH3COOH=CH3COO-+HClO能发生;
d.K2(H2CO3)<K(HClO)\,则反应2ClO-+CO2+H2O=CO32-+2HClO不能发生。
②碳酸钠溶液中各离子浓度关系,可通过写出电离、水解方程式进行分析。
(2)从图中可以看出,稀释后HX的pH大,则溶液中的c(OH-)大,水的电离程度大,从而可确定HX溶液中水电离出来的c(H+)与醋酸溶液中水电离出来的c(H+)的关系;
(3)①完全沉淀后,先求出溶液中c(Cl-),再利用AgCl的Ksp=1.0×10-10,求出c(Ag+)。
②完全沉淀后,H+未参加反应,求出溶液中的c(H+),最后求溶液的pH。
(1)①分析表格中数据可知,电离常数CH3COOH>H2CO3>HClO,由此可得出三种酸从强到弱依次是CH3COOH>H2CO3>HClO;下列反应不能发生的是b、d。答案为:CH3COOH>H2CO3>HClO;b、d;
a.K(CH3COOH)> K1(H2CO3),反应CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O能发生;
b.K(HClO)<K1(H2CO3),反应CO32-+2HClO=CO2↑+H2O+2ClO-不能发生;
c.K(CH3COOH)> K(HClO),反应ClO-+CH3COOH=CH3COO-+HClO能发生;
d.K2(H2CO3)<K(HClO)\,则反应2ClO-+CO2+H2O=CO32-+2HClO不能发生。
②在碳酸钠溶液中发生如下反应:Na2CO3=2Na++CO32-、CO32-+H2O![]() HCO3-+OH-、
HCO3-+OH-、
HCO3-+H2O![]() H2CO3+OH-、H2O
H2CO3+OH-、H2O![]() H++OH-,且程度由强到弱,则离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
H++OH-,且程度由强到弱,则离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(2)从图中可以看出,稀释后HX的pH大,则溶液中的c(OH-)大,水的电离程度大,则HX溶液中水电离出来的c(H+)>/span>醋酸溶液中水电离出来的c(H+)。答案为:>;
(3)①完全沉淀后,溶液中c(Cl-)=![]() =0.001mol/L,再利用AgCl的Ksp=1.0×10-10,求出c(Ag+)=
=0.001mol/L,再利用AgCl的Ksp=1.0×10-10,求出c(Ag+)=![]() =1.0×10-7mol/L。
=1.0×10-7mol/L。
②完全沉淀后,H+未参加反应,溶液中的c(H+)=![]() =0.01mol/L,溶液的pH=-lgc(H+)=2。答案为:1.0×10-7mol·L-1;2。
=0.01mol/L,溶液的pH=-lgc(H+)=2。答案为:1.0×10-7mol·L-1;2。

 名校课堂系列答案
名校课堂系列答案【题目】CH4-CO2催化重整时发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,向1L的密闭容器中充入0.2molCH4与0.1molCO2,发生CH4-CO2催化重整反应,10min时达到平衡,测得平衡混合物中CO(g)的体积分数为20%,则用CH4表示的反应速率为______,CO2的平衡转化率为______。
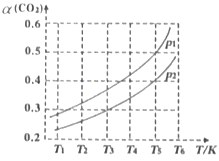
(2)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。由图可知:压强p1______p2(选填“>“、“<“或“=”),理由是______。
(3)在一定温度下,向固定容积为2L的密闭容器中充入0.1moCH4与0.1mo1CO2发生CH4-CO2催化重整反应,达平衡时CO2的平衡转化率为50%,则此条件下该反应的平衡常数为K=______;平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则此时v正______(选填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)=C(s)+2H2(g) | 消碳反应CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。
【题目】10 ℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为______________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为____。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确。原因是____________(写出反应的离子方程式)。能不能选用Ba(OH)2溶液?______(答“能”或“不能”)。
②将加热后的溶液冷却到10 ℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)判断正确。