题目内容
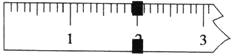
【题目】能够跟1mol ![]() 起反应的Br2或H2的最大用量分别是
起反应的Br2或H2的最大用量分别是
A.1mol,1molB.3.5mol,7mol
C.1mol,7molD.6mol,7mol
【答案】D
【解析】
酚可以与Br2发生苯环上邻、对位上的取代反应,物质分子中共含有3个酚羟基,1mol该化合物可与5mol溴发生取代反应;含有不饱和的碳碳双键,可以与Br2发生加成反应,含有1个碳碳双键,则1mol该化合物可与1mol溴发生加成反应,因此与Br2发生反应,共消耗6molBr2。分子中含有苯环和碳碳双键都可以与H2发生加成反应,分子中含有2个苯环,1个碳碳双键,则1mol该化合物可与7mol氢气发生加成反应,所以1mol该化合物反应消耗Br2或H2的最大用量分别是6mol、7mol,故合理选项是D。

【题目】(1)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。