题目内容
 (1)已知298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ.写出该反应的热化学方程式:
(1)已知298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ.写出该反应的热化学方程式:(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式:
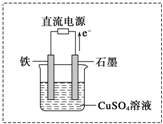
(3)在如图实验装置中,石墨棒上的电极反应式为
如果起始时盛有1 000mL pH=5的硫酸铜溶液(25℃)(CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),可向溶液中加入
考点:原电池和电解池的工作原理,热化学方程式,电解原理
专题:
分析:(1)298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ,则2molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量3116.6kJ,据此写成热化学方程式;
(2)根据原电池中负极失电子,发生氧化反应;正极上得到电子,发生还原反应;分析电极反应,根据电子守恒结合总反应和正极反应计算得到负极电极反应;
(3)电解池中电子流出的电极为阳极,溶液中水在阳极失去电子发生氧化反应生成氧气与氢离子;根据电解硫酸铜溶液的反应特征分析判断恢复溶液浓度需要加入的物质,依据电荷守恒计算需要加入物质的质量.
(2)根据原电池中负极失电子,发生氧化反应;正极上得到电子,发生还原反应;分析电极反应,根据电子守恒结合总反应和正极反应计算得到负极电极反应;
(3)电解池中电子流出的电极为阳极,溶液中水在阳极失去电子发生氧化反应生成氧气与氢离子;根据电解硫酸铜溶液的反应特征分析判断恢复溶液浓度需要加入的物质,依据电荷守恒计算需要加入物质的质量.
解答:
解:(1)298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ,则2molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量3116.6kJ,其热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(1)△H=-3 116.6 kJ?mol-1;
故答案为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(1)△H=-3 116.6 kJ?mol-1;
(2)利用反应①2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;设计原电池,根据化合价变化分析判断,乙烷失电子发生氧化反应,所以通入乙烷气体的电极应为负极,正极电极反应为:②O2+2H2O+4e-=4OH-;①-②×7得到负极电极反应为:C2H6-14e-+18OH-═2CO32-+12H2O;
故答案为:C2H6-14e-+18OH-═2CO32-+12H2O;
(3)如图所示实验装置中,石墨棒上是电子流出一端,电解池中电子流出的是阳极,所以阳极电极反应为氢氧根离子放电,电极反应为:4OH--4e-═O2↑+2H2O;
起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),反应的化学方程式为2CuSO4+2H2O
2Cu+2H2SO4+O2↑根据PH的变化可知生成的硫酸近似为0.05mol,消耗硫酸铜0.05mol,消耗水0.05mol,所以需要加入与硫酸反应能生成硫酸铜0.05mol,水0.05mol的物质,所以加入氧化铜的质量=0.05mol×80g/mol=4g;
故答案为:4OH--4e-=2H2O+O2↑;氧化铜;4.
故答案为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(1)△H=-3 116.6 kJ?mol-1;
(2)利用反应①2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;设计原电池,根据化合价变化分析判断,乙烷失电子发生氧化反应,所以通入乙烷气体的电极应为负极,正极电极反应为:②O2+2H2O+4e-=4OH-;①-②×7得到负极电极反应为:C2H6-14e-+18OH-═2CO32-+12H2O;
故答案为:C2H6-14e-+18OH-═2CO32-+12H2O;
(3)如图所示实验装置中,石墨棒上是电子流出一端,电解池中电子流出的是阳极,所以阳极电极反应为氢氧根离子放电,电极反应为:4OH--4e-═O2↑+2H2O;
起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),反应的化学方程式为2CuSO4+2H2O
| ||
故答案为:4OH--4e-=2H2O+O2↑;氧化铜;4.
点评:本题考查了热化学方程式的书写、燃料电池电极反应式的书写、有关电解池计算,题目难度中等,明确电解池工作原理是解题关键.

练习册系列答案
相关题目
某二元酸H2A在水中发生电离:H2A=H++HA-(完全电离),HA-?H++A2-.下列叙述中一定不正确的是( )
| A、在NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+) |
| B、在Na2A溶液中:c(Na+)>c(A2-)>c(OH-)>c(H+) |
| C、在NaHA溶液中:c(H+)=c(A2-)+c(OH-) |
| D、在H2A溶液中:c(H+)=c(HA-)+c(OH-)+2c(A2-) |
下列能用或图装置制取气体并能“随开随用、随关随停”的是( )

| A、锌粒和稀硫酸制取氧气 |
| B、电石和水制取乙炔 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、大理石和稀硫酸制取二氧化碳 |
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
| A、由水电离的c(H+):①=②>③=④ |
| B、将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |
下列有关实验操作的叙述正确的是( )
| A、实验室常用稀硫酸和石灰石制取CO2 |
| B、实验室可用250mL容量瓶长期贮存0.1mol/L NaCl溶液 |
| C、取5.00mL1.00mol?L-1 盐酸,注入于容积为50mL的容量瓶中,加水稀释至刻度线,即可配得0.100mol?L-1 盐酸 |
| D、用苯萃取碘水中的碘,分液时有机层应从分液漏斗的上口倒出 |
在溶液中能与Fe3+共存的微粒是( )
| A、Cu |
| B、S2- |
| C、CO32- |
| D、Fe2+ |
下列有关实验室一般事故的预防和处理方法正确的是( )
| A、如果苯酚浓溶液沾到皮肤上,应立即用稀氢氧化钠溶液清洗 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭 |
| D、蒸发溶液时有液滴飞溅,应立即加水冷却 |
下列热化学方程式能表示可燃物燃烧热的是( )
| A、H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3 kJ?mol-1 | ||
| C、2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1 | ||
D、CO(g)+
|