题目内容
如图表示各物质之间的转化关系.已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液.

请按要求填空:
(1)写出B的电子式: .
(2)写出用A作电极电解G溶液,在电极上生成E的反应式: ,反应⑤的现象是 .
(3)反应①的化学方程式是 ,反应④在生产中有重要应用,被称为 反应.
(4)反应⑥的离子方程式是 .

请按要求填空:
(1)写出B的电子式:
(2)写出用A作电极电解G溶液,在电极上生成E的反应式:
(3)反应①的化学方程式是
(4)反应⑥的离子方程式是
考点:无机物的推断
专题:推断题
分析:X常温下为无色液体,B为淡黄色固体,二者反应生成单质F与G,应是过氧化钠与水反应,故X为H2O,B为B为Na2O2,G为NaOH,F为O2;A既能与水在高温下反应生成单质D,又可做电极电解氢氧化钠溶液得到D,且E在氧气和水的作用下得到J,J溶于酸为黄色溶液,则A为Fe,C为Fe3O4,D为H2,E为Fe(OH)2,J为Fe(OH)3;H既能与氢氧化钠溶液反应,又能与Fe3O4反应,故为金属Al,由此可知I 为Al2O3,K为NaAlO2,结合对应物质的性质以及题目要求可解答该题.
解答:
解:X常温下为无色液体,B为淡黄色固体,二者反应生成单质F与G,应是过氧化钠与水反应,故X为H2O,B为B为Na2O2,G为NaOH,F为O2;A既能与水在高温下反应生成单质D,又可做电极电解氢氧化钠溶液得到D,且E在氧气和水的作用下得到J,J溶于酸为黄色溶液,则A为Fe,C为Fe3O4,D为H2,E为Fe(OH)2,J为Fe(OH)3;金属H既能与氢氧化钠溶液反应,又能与Fe3O4反应,故H为金属Al,由此可知I为Al2O3,K为NaAlO2,
(1)B为Na2O2,电子式为: ,故答案为:
,故答案为: ;
;
(2)写出用Fe作电极电解NaOH溶液,在电极上生成Fe(OH)2的反应式:Fe+2OH--2e-=Fe(OH)2,反应⑤氢氧化亚铁不稳定,遇到氧气和水会迅速由白色变成灰绿色最终变为红褐色;
故答案为:Fe+2OH--2e-=Fe(OH)2;迅速由白色变成灰绿色最终变为红褐色;
(3)反应①的化学方程式是3Fe+4H2O
Fe3O4+4H2,反应④在生产中有重要应用,被称为铝热反应,故答案为:3Fe+4H2O
Fe3O4+4H2;铝热;
(4)反应⑥的离子方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(1)B为Na2O2,电子式为:
 ,故答案为:
,故答案为: ;
;(2)写出用Fe作电极电解NaOH溶液,在电极上生成Fe(OH)2的反应式:Fe+2OH--2e-=Fe(OH)2,反应⑤氢氧化亚铁不稳定,遇到氧气和水会迅速由白色变成灰绿色最终变为红褐色;
故答案为:Fe+2OH--2e-=Fe(OH)2;迅速由白色变成灰绿色最终变为红褐色;
(3)反应①的化学方程式是3Fe+4H2O
| ||
| ||
(4)反应⑥的离子方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查无机物推断,涉及Fe、Al元素化合物性质,侧重于学生的分析能力的考查,物质的性质和反应现象,铝热反应,电解原理是解题关键,题目难度中等,需要熟练掌握物质性质.

练习册系列答案
相关题目
 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、相等物质的量浓度的气态氢化物溶液的pH:X>Z>W |
| C、最高价氧化物对应水化物的酸性:Z>W>X |
| D、四种元素的单质中,Z单质的熔沸点最低 |
下列各组反应中,前者属于取代反应,后者则属于加成反应的是( )
| A、乙酸、乙醇和浓H2SO4混合共热;乙醛和Cu(OH)2悬浊液共热 |
| B、乙醇和浓H2SO4加热到170℃;乙醇与灼热的铜反应 |
| C、苯酚溶液中滴加溴水;乙烯通入溴水 |
| D、苯和氢气在镍催化下加热反应;苯和液溴、铁粉混合 |
 下列反应中的能量变化符合如图的是 ( )
下列反应中的能量变化符合如图的是 ( )| A、酸与碱的中和反应 |
| B、石灰石分解反应 |
| C、氧化钙和水反应 |
| D、乙醇在空气中燃烧 |
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.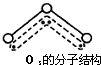 ,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答: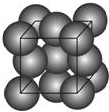 金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.