题目内容
11.将5.6g Cu、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下混合气体VL(HNO3被还原为NO和NO2);若向反应后的溶液中加入足量氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为10.7g,则下列分析正确的是( )| A. | 沉淀中氢氧根的质量为5.1g | B. | V为2.24L | ||
| C. | Cu的物质的量为0.1mol | D. | 反应后溶液呈中性 |
分析 反应后的溶液中加入足量氢氧化钠溶液,金属元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,质量增加量为沉淀中OH-的质量,计算氢氧根的物质的量,由电荷守恒可知,金属提供电子等于沉淀中氢氧根的物质的量,采用极值法计算:假设得到的气体全是NO,假设得到的气体全是NO2,根据电子转移守恒计算气体物质的量,再计算生成气体体积,混合气体体积在二者之间;设混合物中Cu、Mg的物质的量分别为x、y,则根据质量可得64x+24y=5.6g,根据电子守恒可得2x+2y=0.3mol,据此计算出铜的物质的量.
解答 解:反应后的溶液中加入足量氢氧化钠溶液,金属元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,质量增加量为沉淀中OH-的质量,所以m(OH-)=10.7g-5.6g=5.1g,则n(OH-)=$\frac{5.1g}{17g/mol}$=0.3 mol,由电荷守恒可知,金属提供电子等于沉淀中氢氧根的物质的量,即Cu、Mg共失去0.3 mol电子,
A.根据分析可知,沉淀中氢氧根的质量为5.1g,故A正确;
B.假设得到的气体全是NO,由电子转移守恒可知,n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,所以NO体积是:0.1 mol×22.4 L/mol=2.24 L,
假设得到的气体全是NO2,由电子转移守恒可知,n(NO2)=$\frac{0.3mol}{5-4}$=0.3mol,所以NO2体积是:0.3 mol×22.4 L/mol=6.72 L,
因为得到是混合气体,因此体积在二者之间,即2.24<V<6.72,故B错误;
C.设混合物中Cu、Mg的物质的量分别为x、y,则64x+24y=5.6g、2x+2y=0.3mol,解得:0.05mol、y=0.1mol,即:铜的物质的量为0.05mol,故C错误;
D.反应后生成硝酸镁、硝酸铜,铜离子部分水解,溶液呈酸性,故D错误;
故选A.
点评 本题考查了混合物反应计算,题目难度中等,利用守恒思想计算,避免难以确定Fe反应后的价态,明确氢氧根离子所带电荷等于金属失去的电子为解答关键,试题培养了学生的化学计算能力.

| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量水解液加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
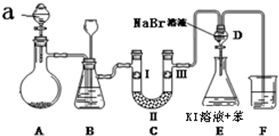
(1)a仪器的名称是:分液漏斗.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2).和浓盐酸,写出反应的化学反应方程式Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)c.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为2Cu+FeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2;
(4)电解精炼.
下列说法正确的是( )
| A. | 上述灼烧过程的尾气均可直接排到空气中 | |
| B. | 由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2中,作氧化剂的只有Cu2O | |
| D. | 电解精炼时,粗铜应与外电源正极相连 |
| A. | 化合物的名称为2-甲基-5-乙基己烷 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是高分子化合物,一定条件下都能发生水解反应 | |
| C. | 在蛋白质溶液中加入硫酸铜溶液和福尔马林,均能使蛋白质变性,失去生理功能 | |
| D. | CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物 |

 D 的原子结构示意图
D 的原子结构示意图 .
.