题目内容
20.下列反应属于氧化还原反应的是( )| A. | 硫酸与氢氧化钡 | B. | 小苏打受热分解 | ||
| C. | 高锰酸钾受热分解 | D. | Na2O溶于水 |
分析 氧化还原反应的特征为化合价变化,所以反应中存在元素的化合价变化的反应为氧化还原反应,据此对各选项进行判断.
解答 解:A.硫酸与氢氧化钡反应生成硫酸钡沉淀和水,该反应为复分解反应,不属于氧化还原反应,故A错误;
B.小苏打为碳酸氢钠,碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,该反应中没有化合价变化,不属于氧化还原反应,故B错误;
C.高锰酸钾分解生成锰酸钾、二氧化锰和氧气,该反应中有化合价变化,属于氧化还原反应,故C正确;
D.氧化钠与水反应生成氢氧化钠,该反应中没有化合价变化,不属于氧化还原反应,故D错误;
故选C.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的特征为解答关键,注意掌握氧化还原反应的概念及判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
10.下列关于物质用途的叙述中不正确的是( )
| A. | 纯碱可用于治疗胃酸过多的药剂 | |
| B. | 铝制容器可用于常温下贮存、运输浓硫酸 | |
| C. | 二氧化硅可用于制造光导纤维和石英坩埚 | |
| D. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 |
11.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 将1molCH3COONa溶于水,向其中加入醋酸至溶液pH=7,此溶液中CH3COO-的数目约为6.02×1023 | |
| B. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-CH3COONa溶液与0.1mol•L-HCl溶液等体积混合:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| D. | 10mL0.1mol•L-1醋酸溶液与20mL0.1mol•L-NaOH溶液混合:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) |
8.NO、NO2、O2的混合.甲、乙、丙三只烧瓶的容积相等,甲烧瓶按体积比为1:1充入NO与O2,乙烧瓶按体积比为1:1充入NO2与O2,丙烧瓶按体积为1:1:1充入NO、NO2和O2的混合气体,将三支烧瓶都充满气体后倒置于水槽中,当液面不再上升时,烧瓶中液本体积之比为( )
| A. | 1:3:4 | B. | 1:3:1 | C. | 7:5:9 | D. | 7:5:8 |
15.Na、Mg、Al各1摩尔分别与足量的稀硫酸反应,产生气体最多的是( )
| A. | Na | B. | Mg | C. | Al | D. | 一样多 |
5.在碱性溶液中能大量共存的离子组是( )
| A. | K+、Fe2+、NO3-、Cl- | B. | Na+、SO42-、Ba2+、H+ | ||
| C. | Na+、CO32-、Cl-、NO3- | D. | Al3+、K+、Cl-、SO42- |
6.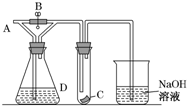 如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
 如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
3.在恒容的密闭容器中,下列能够判断可逆反应2A(g)+3B(g)?4C(g)+D(g) 已达到化学平衡状态的是( )
| A. | 单位时间内生成3n molB,同时消耗4n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
4.利用右图所示装置进行下列实验,试管②中一定观察不到的现象是( )
| 选项 | a | b | c | 试管②中现象 | 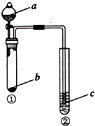 |
| A | NaOH溶液 | 铝 | 肥皂水 | 肥皂泡可点燃 | |
| B | 浓硫酸 | Na2SO3 | Na2SiO3溶液 | 生成白色胶状沉淀 | |
| C | 浓硫酸 | 铜 | 品红溶液 | 溶液红色褪去 | |
| D | 水 | Na2O2 | 酸化的KI溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |