题目内容
某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求回答下列问题:
(1)实验装置如下:
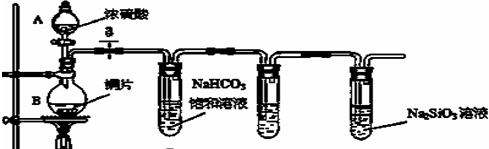
填写所示仪器名称A
(2)实验步骤:
连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液的作用是 .
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 .
(1)实验装置如下:

填写所示仪器名称A
(2)实验步骤:
连接仪器、
(3)问题探究:(已知酸性强弱亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:(1)根据装置图中的仪器分析;
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此写出反应方程式;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强.
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此写出反应方程式;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强.
解答:
解:(1)根据装置图中的仪器可知A为分液漏斗,B为圆底烧瓶,
故答案为:分液漏斗;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;除去SO2气体;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀.
故答案为:分液漏斗;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀.
点评:本题考查了非金属性的相对强弱的探究实验,涉及仪器名称,化学方程式的书写,判断非金属性强弱的依据等 考查的知识点较多,难度中等.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列有关说法不正确的是( )


| A、水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 |
| B、CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+ |
| C、H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 |
| D、金属Cu中Cu原子堆积模型如图4,为最密堆积,每个Cu原子的配位数均为12 |




