题目内容
设NA为阿伏伽德罗常数的值,下列叙述不正确的是( )
| A、0.5L1mol/L NaHS溶液中,钠离子个数为0.5NA |
| B、常温下,18g D2O中所含有的电子个数为9NA |
| C、标况下,22.4L甲烷中含有共价键数为4NA |
| D、1L1mol/L醋酸溶液的质量与NA个醋酸分子的质量相等 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.NaHS为强电解质,完全电离,钠离子为强碱阳离子,不水解;
B.将质量转化为物质的量,结合1个D2O中所含有的电子个数解答;
C.将体积转化物质的量,结合甲烷的结构解答;
D.1L1mol/L醋酸溶液除了含有溶质醋酸外还含有溶剂水.
B.将质量转化为物质的量,结合1个D2O中所含有的电子个数解答;
C.将体积转化物质的量,结合甲烷的结构解答;
D.1L1mol/L醋酸溶液除了含有溶质醋酸外还含有溶剂水.
解答:
解:A.0.5L1mol/L NaHS溶液中,含NaHS的物质的量为0.5L×1mol/L=0.5mol,NaHS为强电解质,完全电离,产生0.5mol钠离子,所以钠离子个数为0.5NA,故A正确;
B.18g D2O的物质的量为
=0.9mol,含有的电子个数为0.9mol×10×NA=9NA,故B正确;
C.标况下,22.4L甲烷的物质的量为
=1mol,1个甲烷分子含有4个C-H键,则1mol甲烷中含有共价键数为4NA,故C正确;
D.1L1mol/L醋酸溶液含醋酸分子的物质的量为1L×1mol/L=1mol,但是醋酸溶液中除了含有醋酸溶质外还含有溶剂水,所以1L1mol/L醋酸溶液的质量大于NA个醋酸分子的质量,故D错误;
故选:D.
B.18g D2O的物质的量为
| 18g |
| 20g/mol |
C.标况下,22.4L甲烷的物质的量为
| 22.4L |
| 22.4L/mol |
D.1L1mol/L醋酸溶液含醋酸分子的物质的量为1L×1mol/L=1mol,但是醋酸溶液中除了含有醋酸溶质外还含有溶剂水,所以1L1mol/L醋酸溶液的质量大于NA个醋酸分子的质量,故D错误;
故选:D.
点评:本题考查了阿伏伽德罗常数的应用,题目难度不大,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
柠檬酸的结构简式如图,下列说法正确的是( )
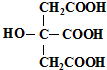
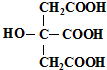
| A、柠檬酸中能发生酯化反应的官能团有2种 |
| B、1 mol柠檬酸可与4 mol NaOH发生中和反应 |
| C、1 mol柠檬酸与足量金属Na反应生成生成1.5mol H2 |
| D、柠檬酸与O2在Cu作催化剂,加热的条件下,能发生氧化反应 |
分析下表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是( )
①是己酸②是己醇 ③是戊酸甲酯 ④在稀硫酸中易变质⑤一定能与钠反应.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、②⑤ | B、①③④ |
| C、③④ | D、②③⑤ |
下列物质与用途对应关系错误的是( )
| A、盐酸-金属除锈 |
| B、烧碱-治疗胃酸过多 |
| C、干冰-人工降雨 |
| D、小苏打-焙制糕点 |
把一定质量Na2CO3、NaHCO3、Na2CO3?xH2O的混合物等分两份,一份溶于水配成200毫升溶液时,测得溶液中C(Na+)=1.5mol/L.若将另一份加热到质量不在变化时的固体质量为( )
| A、15.9 g |
| B、21.2 g |
| C、88.2 g |
| D、条件不够,无法计算 |
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为( )
| A、v(NH3)=0.01mol/(L?s) |
| B、v(O2)=0.001mol/(L?s) |
| C、v(H2O)=0.045mol/(L?s) |
| D、v(NO)=0.001mol/(L?s) |
钠着火时可以用于灭火的是( )
| A、水 | B、砂 |
| C、干粉灭火器 | D、泡沫灭火器 |
下列反应中,属于氧化还原反应的是( )
| A、NaOH+HCl═NaCl+H2O |
| B、Cl2+H2O═HCl+HClO |
| C、CuSO4+BaCl2═BaSO4↓+CuCl2 |
| D、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
工业上可利用甲烷除去NO气体,反应为CH4(g)+4NO(g)?CO2(g)+2N2(g)+2H2O(g)△H<0.在恒容的密闭容器中,下列有关说法正确的是( )
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、单位时间内消耗CH4和N2的物质的量比为1:2时,反应达到平衡 |
| C、平衡时,其他条件不变,增加CH4的浓度,氮氧化物的转化率减小 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |