题目内容
将纯水加热至90℃时,下列叙述正确的是( )
| A、水的离子积变大、pH变小、呈酸性 |
| B、水的离子积不变、pH不变、呈中性 |
| C、水的离子积变小、pH变大、呈碱性 |
| D、水的离子积变大、pH变小、呈中性 |
考点:离子积常数,水的电离
专题:电离平衡与溶液的pH专题
分析:水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,但溶液中仍然存在c(H+)=c(OH-),据此分析解答.
解答:
解:水的电离是吸热反应,升高温度促进水电离,则c(H+)、c(OH-)都增大,所以水的离子积常数增大,溶液的pH减小,但溶液中仍然存在c(H+)=c(OH-),所以溶液呈中性,故选D.
点评:本题考查水的电离及离子积常数与温度的关系,明确化学平衡常数、电离平衡常数、盐类水解平衡常数、难溶物的溶度积常数都只与温度有关,与溶液酸碱性、浓度无关,注意不能根据pH大小判断溶液酸碱性,要根据c(H+)、c(OH-)相对大小判断溶液酸碱性,为易错点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是( )
| A、烧杯中有铜无铁 |
| B、烧杯中有铁无铜 |
| C、烧杯中铁铜都有 |
| D、烧杯中铁铜都无 |
在室温下,下列叙述正确的是( )
| A、将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| B、将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8 |
| C、用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D、ph=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是( )
| A、Cl2+H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、Na2O+H2O=2NaOH |
| D、2Na+H2O=2NaOH+H2 |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,W和X能形成X2W和X2W2两种常见化合物,下列说法错误的是( )
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是( )
| A、AlCl3 和NaOH |
| B、Na2CO3和HCl |
| C、NaHCO3和HCl |
| D、NaAlO2和HCl |
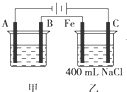 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答: