题目内容
取100mL 0.3mol/L和300mL 0.25mol/L的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A、0.21 mol/L |
| B、0.42 mol/L |
| C、0.56 mol/L |
| D、0.24 mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:先计算出两硫酸溶液中硫酸、氢离子的总物质的量,再根据c=
及稀释过程中氢离子总物质的量不变计算出配制的500mL溶液中氢离子的物质的量浓度即可.
| n |
| V |
解答:
解:100mL 0.3mol/硫酸溶液中含有硫酸的物质的量为:0.3mol/L×0.1L=0.03mol,
300mL 0.25mol/L的硫酸溶液中含有的硫酸子物质的量为:0.25mol/L×0.3L=0.075mol,
配制的500mL溶液中含有硫酸总物质的量为:0.03mol+0.075mol=0.0105mol,含有氢离子的物质的量为:0.0105mol×2=0.021mol,混合液中H+的物质的量浓度为:c(H+)=
=0.42mol/L,
故选B.
300mL 0.25mol/L的硫酸溶液中含有的硫酸子物质的量为:0.25mol/L×0.3L=0.075mol,
配制的500mL溶液中含有硫酸总物质的量为:0.03mol+0.075mol=0.0105mol,含有氢离子的物质的量为:0.0105mol×2=0.021mol,混合液中H+的物质的量浓度为:c(H+)=
| 0.021mol |
| 0.5L |
故选B.
点评:本题考查了物质的量浓度计算,题目难度不大,注意掌握物质的量浓度概念及计算方法,明确氢离子与溶质硫酸的组成关系及稀释过程中溶质的物质的量不变.

练习册系列答案
相关题目
下列反应中,硝酸既表现了氧化性又表现了酸性的是( )
| A、C+浓HNO3 |
| B、Cu+稀HNO3 |
| C、CuO+浓HNO3 |
| D、NaOH+HNO3 |
氢气在氯气中燃烧产生苍白色火焰,在反应中破坏1mol氢气中的化学键消耗的能量为a KJ,破坏1mol 氯气中的化学键消耗的能量为b KJ,形成1mol氯化氢中的化学键释放的能量为c KJ.下列关系式中正确的是( )
| A、a+b>c |
| B、a+b>2c |
| C、a+b<c |
| D、a+b<2c |
有关化学用语正确的是( )
| A、氯乙烷的分子式C2H5Cl |
| B、乙醇的结构简式C2H6O |
C、四氯化碳的电子式 |
| D、乙烯的结构简式CH2CH2 |
(1)已知氢气的燃烧热为285.8kJ/mol,则H2(g)+
O2(g)═H2O(l)△H= ;
(2)用离子方程式来表示强酸和强碱的中和热(焓变的数值为57.3):
H+(aq)+ ═ ,△H= .
| 1 |
| 2 |
(2)用离子方程式来表示强酸和强碱的中和热(焓变的数值为57.3):
H+(aq)+
下列电离方程式中,正确的是( )
| A、Ca(OH)2=Ca2++2(OH-) |
| B、FeCl3=Fe2++3Cl- |
| C、Al2(SO4)3=2Al3++3SO42- |
| D、H2SO4=H2++SO42- |
芪三酚(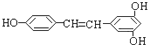 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A、1mol,1mol |
| B、3.5mol,7mol |
| C、5mol,7mol |
| D、6mol,7mol |