题目内容
8.下面有关晶体的叙述中,正确的是( )| A. | 原子晶体中只存在非极性共价键 | |
| B. | 在氯化钠晶体中每个Na+(或Cl-)周围都紧邻8个Cl-(Na+) | |
| C. | 离子晶体在熔化时,离子键被破坏 | |
| D. | 熔融状态下导电的晶体一定是金属晶体 |
分析 A、原子晶体是原子之间通过共价键形成的晶体,同种原子之间形成的共价键是非极性键,不同元素形成的共价键是极性键;
B、根据氯化钠晶胞图 确定离子配位数;
确定离子配位数;
C、离子晶体是通过离子键将阴、阳离子结合在一起的;
D、离子晶体在熔融状态下能够导电.
解答 解:A、二氧化硅是原子晶体,晶体中存在极性键,故A错误;
B、已知氯化钠的晶胞图为 ,则氯化钠晶胞中,钠离子的配位数为6,即在氯化钠晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(Na+),故B错误;
,则氯化钠晶胞中,钠离子的配位数为6,即在氯化钠晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(Na+),故B错误;
C、离子晶体是通过离子键将阴、阳离子结合在一起的,所以熔化时,离子键被破坏,故C正确;
D、金属晶体、离子晶体在熔融状态下都能够导电,所以熔融状态下导电的晶体不一定是金属晶体,故D错误.
故选C.
点评 本题主要考查晶胞结构、晶体微粒间作用、晶体性质、化学键等,难度不大,明确物质构成微粒及微粒之间作用力是解本题关键.

练习册系列答案
相关题目
19.实验室要制取少量的Al(OH)3,选用的试剂最合理的是( )
| A. | AlCl3溶液和氨水 | B. | AlCl3溶液和CO2 | ||
| C. | NaAlO2溶液和盐酸 | D. | NaAlO2溶液和NaOH溶液 |
20.某K2CO3固体样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种.现将13.8g样品加入足量水中,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀.对样品所含杂质判断完全正确的是( )
| A. | 肯定有KNO3,可能还含有Na2CO3 | B. | 肯定有Na2CO3,肯定没有KNO3 | ||
| C. | 肯定没有Ba(NO3)2,可能有KNO3 | D. | 肯定没有Na2CO3和Ba(NO3)2 |
17.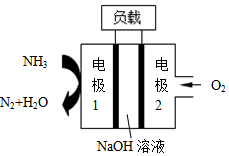 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,下列有关说法正确的是( )
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,下列有关说法正确的是( )| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作时电极2附近溶液的pH减小 | |
| C. | 电池总反应为:4NH3+3O2=2N2+6H2O | |
| D. | 电极1发生的电极反应为:2NH3-6e-=N2+6H+ |
3.下列说法正确的是( )
| A. | 葡萄糖、果糖和蔗糖都能发生水解反应 | |
| B. | 油脂有油和脂肪之分,但都属于酯 | |
| C. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
13.下列实验能达到预期目的是( )
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做银镜反应实验--检验淀粉是否完全水解 | |
| B. | 欲除去混在苯中的少量苯酚,可以加入氢氧化钠溶液后,充分振荡,静置后分液 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热--检验混合物中是否含有甲醛 |
20.生石灰(CaO)中往往含有杂质CaCO3和SiO2,要检验是否存在这两种杂质,最好选用( )
| A. | H2O | B. | HCl溶液 | C. | H2SO4溶液 | D. | NaOH溶液 |
17.已知通常分子中所含的键能越大,分子越稳定.参考表中化学键的键能数据,判断下列分子中,受热时最不稳定的是( )
| 化学键 | H-H | H-Cl | H-Br | H-I |
| 键能KJ•mol-1 | 436.0 | 431.8 | 366 | 298.7 |
| A. | 氢气 | B. | 氯化氢 | C. | 溴化氢 | D. | 碘化氢 |
18.amL两种气态烃按任意比例混合后与足量的氧气混合点燃后,恢复到原来的状态(常温、常压),体积总共缩小2amL.则两种烃可能是( )
| A. | CH4、C2H4 | B. | C2H6、C3H6 | C. | CH4、C2H6 | D. | C2H6、C2H2 |