题目内容
3.按要求回答下列各题:(1)在25℃时,某溶液中由水电离出的c(H+)=1×10-12mol•L-1,则该溶液的pH为2或12.
(2)已知在100℃的温度下,水的离子积KW=1×10-12,该温度下,将pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比.
①若所得混合液为中性,则a:b=10:1;
②若所得混合液的pH=2,则a:b=9:2.
分析 (1)在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-10}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
根据反应后溶液的酸碱性判断反应的程度,以此计算.
解答 解:(1)25℃时:Kw=c(OH-)×c(H+)=10-14,纯水中c(H+)=c(OH-)=1.0×10-7 mol/L,在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,如果为酸溶液,则pH=2,如果为盐溶液,则pH=12,故答案为:2或12;
(2)在100℃的温度下,水的离子积KW=1×10-12,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-10}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则
①若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,
故答案为:10:1;
②若所得混合液的pH=2,则有$\frac{0.1b-0.01a}{a+b}$=0.01,a:b=9:2,
故答案为:9:2.
点评 本题考查酸碱混合的定性判断,题目难度中等,注意水的离子积常数的计算,把握相关计算公式的运用.


| A. | 30min时降低温度,40min时升高温度 | |
| B. | 前8min A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
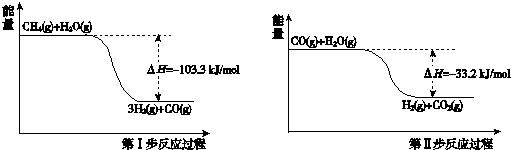
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol.
(2)第II步为可逆反应.在800℃时,若CO的起始浓度为2.0mol/L,水蒸气的起始浓度为3.0mol/L,达到化学平衡状态后,测得CO2的浓度为1.2mol/L,则此反应的平衡常数为1,随着温度升高该反应的化学平衡常数的变化趋势是变小.
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是bc(填序号).
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b.单位时间内断开amol H-H键的同时断开2a mol O-H键
c.反应容器中放出的热量不再变化
d.混合气体的密度不再发生变化
e.混合气体的压强不再发生变化
(4)某温度下,第Ⅱ步反应的平衡常数为K=$\frac{1}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示.下列判断不正确的是CD.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2O)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D.平衡时,乙中H2O的转化率大于25%
 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题: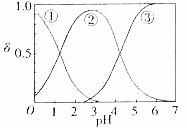 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.