题目内容
8.下列离子方程式中,书写正确的是( )| A. | 钠投入到氯化镁溶液中:2Na+Mg2+═Mg+2 Na+ | |
| B. | 把金属钠放入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 将氯水加入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| D. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O |
分析 A.不符合反应客观事实;
B.电荷不守恒;
C.二者反应生成氯化钾和碘单质;
D.碳酸钙为沉淀,应保留化学式.
解答 解:A.钠投入到氯化镁溶液中:,反应生成氢氧化镁、氢气和氯化钠,离子方程式:2H2O+2Na+Mg2+═Mg(OH)2↓+H2↑+2 Na+,故A错误;
B.把金属钠放入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.将氯水加入碘化钾溶液中,离子方程式:Cl2+2I-═2Cl-+I2,故C正确;
D.盐酸滴在石灰石上,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循电荷守恒规律,题目难度不大.

练习册系列答案
相关题目
19.下列说法中,正确的是( )
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,可以选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |
16.下列关于0.2mol/LB(NO3)2溶液的说法中,正确的是( )
| A. | 溶液中含有的阴、阳离子总数为共0.6 mol | |
| B. | 在0.5L该溶液中,Ba2+的浓度为0.1 mol/L | |
| C. | 在500 mL该溶液中,含有0.2 mol NO3- | |
| D. | 取1L该溶液稀释到10L时,NO3-的浓度为0.2 mol/L |
3.下列每组分别给出了两个量,不可以求出相应物质的量对是( )
| A | B | C | D |
| 物质微粒数 | 溶质的质量分数 | 标准状况下气体的摩尔体积 | 某物质的质量 |
| 阿伏伽德罗常数 | 溶液体积 | 标准状况下气体的体积 | 该物质的摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关过滤和蒸发实验的操作中不正确的是( )
| A. | 过滤操作时,玻璃棒与三层滤纸相互接触 | |
| B. | 为加快过滤,使用玻璃棒搅动漏斗里的液体 | |
| C. | 蒸发操作时,有大量固体析出后就停止加热 | |
| D. | 蒸发操作时,为防止局部受热应不停搅拌 |
20.某温度(t℃)时,水的离子积为Kω=1×10-13mol2L-2,则该温度与25℃相是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 无法确定 |
17.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.086 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L、M、R、T形成的简单离子的半径最大的是L | |
| B. | 单质与等浓度等体积的稀盐酸反应的速率为Q>L | |
| C. | 气态氢化物稳定性:R>T | |
| D. | M与T形成的化合物既能与强酸反应又能与强碱反应 |
18.以CO、H2、H2O和N2为原料,运用电化学原理合成氨的装置结构如图:下列有关说法不正确的是( )
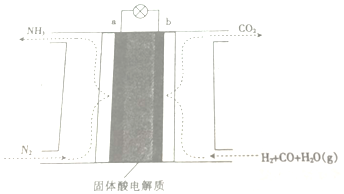

| A. | 放电时,b极表面H2与CO均被氧化 | |
| B. | 该电池工作时,H+由b极区迁移至a极区 | |
| C. | a极的电极反应为N2+6H++6e-=2NH3 | |
| D. | 工作一段时间后b极附近的PH增大 |