题目内容
10.下列指定粒子的个数比不为2:1的是( )| A. | Be2+中的质子数和电子数比 | |
| B. | ${\;}_{1}^{3}$H原子中的中子数和电子数 | |
| C. | Na2CO3晶体中阳离子和阴离子个数比 | |
| D. | BaO2(过氧化钡)固体中阴离子和阳离子个数比 |
分析 根据质量数=质子数+中子数,阳离子的电子数=质子数-电荷数,以及离子化合物中阴阳离子的关系判断.
解答 解:A、Be2+中质子数为4,电子数为2,质子和电子个数比为2:1,故A不选;
B、13H原子中中子数为=3-1=2,电子数为1,则中子数和电子数之比为2:1,故B不选;
C、Na2CO3晶体中阳离子Na+和阴离子CO32-的个数比等于2:1,故C不选;
D、BaO2(过氧化钡)中阴离子O22-和阳离子Ba2+的个数比等于1:1,故D选.
故选:D.
点评 本题考查的是质子数、中子数、电子数之间的关系以及离子化合物中阴阳离子的关系,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
1.关于化学键的各种叙述中,下列说法中正确的是( )
| A. | 在离子晶体里,只存在离子键 | |
| B. | 共价化合物里,一定不存在离子键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 由不同种元素组成的多原子分子里,一定只有极性键 |
5.关于下列图示装置运用的叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.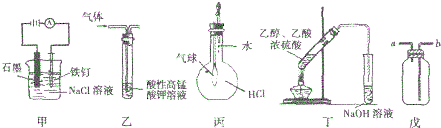
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

| A. | ③⑤ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
15.某元素的最高价氧化物的分子式RO2,其中含R27.27%.对此元素的叙述不正确的是( )
| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
2.下表是元素周期表的一部分,针对表中的①~⑩中元素,用化学用语填空回答以下问题:
(1)在这些元素中,最活泼的非金属元素是F化学性质最不活泼元素原子的原子结构示意图为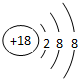 ;
;
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3;
(3)最强碱的电子式为: ①的气态氢化物的电子式:
①的气态氢化物的电子式: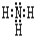 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3;
(3)最强碱的电子式为:
 ①的气态氢化物的电子式:
①的气态氢化物的电子式: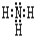 .
.
19.下列实验不合理的是( )
| A. | 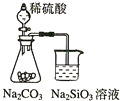 证明非金属性强弱 S>C>Si | B. | 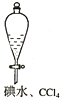 四氯化碳萃取碘水中的碘 | ||
| C. | 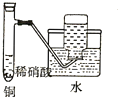 制备并收集少量NO气体 | D. | 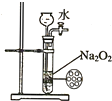 制备少量氧气 |
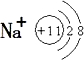 ;B与空气反应的化学方程式2NO+O2=2NO2.
;B与空气反应的化学方程式2NO+O2=2NO2.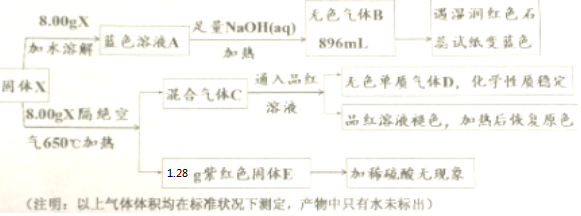
 ;气体D的结构式
;气体D的结构式 .
.