题目内容
20.(Ⅰ)将少量某红棕色气体A通入到稀钠盐溶液甲中,有白色沉淀产生;当红棕色气体通入过量时,白色沉淀完全消失.上述过程中还产生一种无色气体B.B遇空气后又可产生A,则:(1)写出钠离子的结构示意图
 ;B与空气反应的化学方程式2NO+O2=2NO2.
;B与空气反应的化学方程式2NO+O2=2NO2.(2)甲种肯定不含有下列物质中的AC(填选项字母).
A.Na2S B.NaAlO2 C.Na2SiO3 D.NaCl
(3)通入气体A使白色沉淀逐渐消失且产生气体B,该反应的离子方程式是9NO2+Al(OH)3=2Al3++6NO3-+3NO↑.
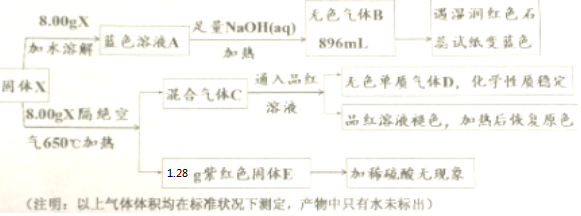
(Ⅱ)某研究小组为了探究一种无机化合物X(化合物X中带有6个结晶水,仅含五种元素,且每种元素在该化合物中均呈现单一价态,X的式量为400)的组成和性质,设计了如下实验:
(1)写出气体B的电子式
 ;气体D的结构式
;气体D的结构式 .
.(2)混合气体C通入品红溶液褪色,加热后恢复原色的原因是二氧化硫能与品红反应,生成不稳定的无色物质,加热时,这些无色物质又会发生分解,恢复原来的颜色.
(3)8.00固体X所含阴离子的物质的量是0.04mol.
(4)固体X受热分解的化学方程式是Cu(NH4)2(SO4)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu+N2↑+2SO2↑+10H2O.
分析 (Ⅰ)将少量某红棕色气体A通入到稀钠盐溶液甲中,有白色沉淀产生;当红棕色气体通入过量时,白色沉淀完全消失.上述过程中还产生一种无色气体B.B遇空气后又可产生A,推断A为NO2,B为NO,红棕色气体A通入到稀钠盐溶液甲中,有白色沉淀产生;当红棕色气体通入过量时,白色沉淀完全消失说明酸中生成的白色沉淀能溶于过量酸中,则判断钠盐为NaAlO2,白色沉淀为Al(OH)3,据此分析回答问题;
(1)钠原子三个电子层,最外层有一个电子,失去最外层电子形成阳离子Na+,B为一氧化氮和空气中的氧气反应生成二氧化氮;
(2)Na2S在硝酸溶液中可以写成硫单质沉淀,但硫不随硝酸增多溶解,Na2SiO3酸溶液中会生成硅酸沉淀,硅酸不溶于过量硝酸,氯化钠无沉淀生成;,偏铝酸钠和硝酸反应生成氢氧化铝,氢氧化铝是两性氢氧化物溶于硝酸;
(3)二氧化氮和水反应生成硝酸和一氧化氮,硝酸溶解氢氧化铝沉淀,生成硝酸铝;
(Ⅱ)固体X加水溶解后成蓝色溶液,说明X中含有Cu2+,加足量NaOH溶液加热有能使湿润的红色石蕊试纸变蓝色的无色气体B放出,则B为NH3气,说明X中含有NH4+; 固体X隔绝空气加热产生混合气体,其中无色单质气体D化学性质稳定,则是氮气(N2),而能使品红溶液褪色,加热后恢复原色的气体,应是SO2,由此可以推出X中含有SO42-;8.00g固体X隔绝空气加热后,有1.28g紫红色固体E产品,加稀硫酸无现象,则该紫红色,固体E是金属铜(Cu).综上分析,再根据题目告知的信息:X是一种无机化合物,X 中带有6个结晶水,仅含五种元素,且每种元素在该化合物中均只有单一价态,X 的式量为400,可以推知固体X是复盐,X为:Cu(NH4)2(SO4)2•6H2O;固体X隔绝空气加热分解的反应是:Cu(NH4)2(SO4)2•6H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+N2↑+2SO2↑+10H2O,据此回答问题;
解答 解:(Ⅰ) 将少量某红棕色气体A通入到稀钠盐溶液甲中,有白色沉淀产生;当红棕色气体通入过量时,白色沉淀完全消失.上述过程中还产生一种无色气体B.B遇空气后又可产生A,推断A为NO2,B为NO,红棕色气体A通入到稀钠盐溶液甲中,有白色沉淀产生;当红棕色气体通入过量时,白色沉淀完全消失说明酸中生成的白色沉淀能溶于过量酸中,则判断钠盐为NaAlO2,白色沉淀为Al(OH)3,某红棕色气体 A是NO2,B是NO,稀钠盐溶液甲是NaAlO2,反应为:3NO2 +2NaAlO2 +4H2O=2Al(OH)3↓+2 NaNO3+NO↑;当红棕 色气体通入过量时,白色沉淀逐渐完全消失,反应离子方程式为:9NO2+2Al(OH)3=2Al (NO3)3+3NO↑+3H2O.
(1)钠原子三个电子层,最外层有一个电子,失去最外层电子形成阳离子Na+,钠离子的结构示意图为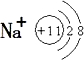 ;B为一氧化氮和空气中的氧气反应生成二氧化氮,B 与空气反应的化学方程式:2NO+O2 =2NO2;
;B为一氧化氮和空气中的氧气反应生成二氧化氮,B 与空气反应的化学方程式:2NO+O2 =2NO2;
故答案为: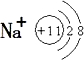 ,2NO+O2 =2NO2;
,2NO+O2 =2NO2;
(2)Na2S在硝酸溶液中可以写成硫单质沉淀,但硫不随硝酸增多溶解,Na2SiO3酸溶液中会生成硅酸沉淀,硅酸不溶于过量硝酸,氯化钠无沉淀生成;,偏铝酸钠和硝酸反应生成氢氧化铝,氢氧化铝是两性氢氧化物溶于硝酸;
A.Na2S能发生氧化还原反应有黄色的S沉淀,但硝酸不能溶解硫,故A符合;
B、Na2SiO3酸溶液中会生成硅酸沉淀,硅酸不溶于过量硝酸,故B错误;
C.Na2SiO3能与酸反应生成难溶于过量NO2的白色沉淀H2SiO3,硅酸不能溶于硝酸,故C符合;
D、NaCl溶液中和二氧化氮生成的硝酸不能反应,无沉淀生成,故D错误;
故甲中肯定不含有A.Na2S,C.Na2SiO3;
故答案为:AC.
(3)通入气体 A 为NO2 ,溶于水生成硝酸和一氧化氮,硝酸使白色沉淀氢氧化铝逐渐消失且产生气体B为NO,该反应的离子方程式是:9NO2+2Al(OH)3 =2Al3++6NO3-+3NO↑+3H2O;
故答案为:9NO2+2Al(OH)3 =2Al3++6NO3-+3NO↑+3H2O;
(Ⅱ)流程分析可知,固体X加水溶解后成蓝色溶液,说明X中含有Cu2+,加足量NaOH溶液加热有能使湿润的红色石蕊试纸变蓝色的无色气体B放出,则B为NH3气,说明X中含有NH4+; 固体X隔绝空气加热产生混合气体,其中无色单质气体D化学性质稳定,则是氮气(N2),而能使品红溶液褪色,加热后恢复原色的气体,应是SO2,由此可以推出X中含有SO42-;8.00g固体X隔绝空气加热后,有1.68g紫红色固体E产品,加稀硫酸无现象,则该紫红色固体E是金属铜(Cu);
综上分析,再根据题目告知的信息:X是一种无机化合物,X 中带有 6 个结晶水,仅含五种元素,且每种元素在该化合物中均只有单一价态,X 的式量为400,可以推知固体X是复盐,X为:Cu(NH4)2(SO4)2•6H2O;固体X隔绝空气加热分解的反应是:Cu(NH4)2(SO4)2•6H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+N2↑+2SO2↑+10H2O;
(1)气体B为氨气,氨气分子中氮原子最外层达到8电子稳定结构,氨气的电子式为 ,气体D 为氮气,气体的结构式为
,气体D 为氮气,气体的结构式为 ;
;
故答案为: ,
, ;
;
(2)混合气体 C 通入品红溶液褪色,加热后恢复原色的原因是:二氧化硫能与品红反应,生成不稳定的无色物质,加热时,这些无色物质又会发生分解,恢复原来的颜色
故答案为:二氧化硫能与品红反应,生成不稳定的无色物质,加热时,这些无色物质又会发生分解,恢复原来的颜色;
(3)X是一种无机化合物,X 中带有 6 个结晶水,仅含五种元素,且每种元素在该化合物中均只有单一价态,X 的式量为400,可以推知固体X是复盐,X为:Cu(NH4)2(SO4)2•6H2O,Cu(NH4)2(SO4)2•6H2O的相对分子质量400,8.00gX物质的量=$\frac{8.00g}{400g/mol}$=0.02mol,所以8.00 固体 X 所含阴离子为SO42-,硫酸根的物质的量是0.04mol;
故答案为:0.04;
(4)依据上述分析可知,固体X 受热分解生成铜、氮气、二氧化硫和水,反应的化学方程式是:Cu(NH4)2(SO4)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu+N2↑+2SO2↑+10H2O;
故答案为:Cu(NH4)2(SO4)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu+N2↑+2SO2↑+10H2O.
点评 本题考查了物质性质和结构的分析判断,主要是反应现象和产物的分析应用,离子方程式和化学方程式书写方法,掌握基础是关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料.合成纤维、合成橡胶 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| D. | 实施“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 |
| A. |  装置:石油的分馏 | |
| B. |  装置:测定中和热 | |
| C. | 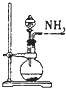 装置:将浓氨水滴加到生石灰中制取氨气 | |
| D. |  装置:加热氯化铵和消石灰混合物,制取并收集氨气 |
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 10min内,T1时CH4的化学反应速率比T2时小 | |
| B. | T1<T2 | |
| C. | 平衡常数:K(T1)<K(T2) | |
| D. | a<0 |
| A. | 非金属性X>Y>Z | |
| B. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| C. | 元素的负化合价的绝对值按X、Y、Z变小 | |
| D. | 原子半径:X>Y>Z |
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多 | |
| D. | 常温时,A能从水中置换出氢,而B不能 |
| A. | CH3CH2COOH | B. | HCOOCH2CH3 | C. | CH3COOCH3 | D. | CH3COCH2OH |
| A. | Be2+中的质子数和电子数比 | |
| B. | ${\;}_{1}^{3}$H原子中的中子数和电子数 | |
| C. | Na2CO3晶体中阳离子和阴离子个数比 | |
| D. | BaO2(过氧化钡)固体中阴离子和阳离子个数比 |