题目内容
5.关于下列图示装置运用的叙述正确的是( )①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.
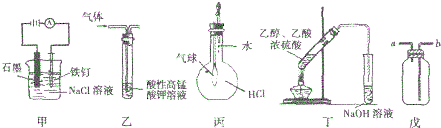
| A. | ③⑤ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
分析 ①Fe与电源正极相连,为阳极;
②乙烯被高锰酸钾氧化生成二氧化碳;
③挤压胶头滴管,HCl极易溶于水,气球变大;
④乙酸乙酯与NaOH反应;
⑤a进收集密度比空气小的气体,b进收集密度比空气大的气体.
解答 解:①Fe与电源正极相连,为阳极,则Fe失去电子被腐蚀,故错误;
②乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应利用溴水、洗气除杂,故错误;
③挤压胶头滴管,HCl极易溶于水,气球变大,则可验证HCl气体在水中的溶解性,故正确;
④乙酸乙酯与NaOH反应,不能除杂,应选饱和碳酸钠溶液除杂,故错误;
⑤a进收集密度比空气小的气体,b进收集密度比空气大的气体,则a进收集H2,b进收集CO2、Cl2、HCl、NO2等,故正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及电化学、物质的性质及气体收集、混合物分离提纯等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 非金属性X>Y>Z | |
| B. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| C. | 元素的负化合价的绝对值按X、Y、Z变小 | |
| D. | 原子半径:X>Y>Z |
13.在检验SO42-的过程中,下列操作中正确的是( )
| A. | 先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存 |
20.取pH均等于2的盐酸和醋酸溶液各100mL.分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
10.下列指定粒子的个数比不为2:1的是( )
| A. | Be2+中的质子数和电子数比 | |
| B. | ${\;}_{1}^{3}$H原子中的中子数和电子数 | |
| C. | Na2CO3晶体中阳离子和阴离子个数比 | |
| D. | BaO2(过氧化钡)固体中阴离子和阳离子个数比 |
15.元素的以下性质,随着原子序数递增不呈现周期性变化的是( )
| A. | 化合价 | B. | 原子半径 | ||
| C. | 元素的金属性和非金属性 | D. | 相对原子质量 |
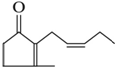 有机化合物A是人工合成的香料茉莉酮,其结构简式如图:
有机化合物A是人工合成的香料茉莉酮,其结构简式如图: