题目内容
 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下表为一些常见化学键键能值.
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下表为一些常见化学键键能值.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC
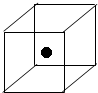
(2)如图所示立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)=Si(s)+4HCl(g)该反应的反应热△H=
考点:键能、键长、键角及其应用,有关反应热的计算
专题:化学反应中的能量变化,化学键与晶体结构
分析:(1)原子晶体熔化过程中需要破坏化学键吸收能量,键能越大熔点越高,原子半径大小分析判断键能大小,分子晶体熔化需要破坏分子间作用力;
(2)硅晶体属于原子晶体,根据晶体硅的空间结构来回答;
(3)根据化学反应方程式中的反应热=反应物的总键能-生成物的总键能来计算,需要注意的是物质的总键能等于键能×分子中键的个数.
(2)硅晶体属于原子晶体,根据晶体硅的空间结构来回答;
(3)根据化学反应方程式中的反应热=反应物的总键能-生成物的总键能来计算,需要注意的是物质的总键能等于键能×分子中键的个数.
解答:
解:(1)物质熔化时需断键,断键需吸收能量,而键能越大的物质,断键所吸收能量越大,熔点越高,依据图表中的键能数值分析可知,键能Si-O>Si-C>Si-Si,所以物质的熔点高低为:SiC>Si;SiCl4属于分子晶体,分子晶体的熔点较低,所以熔点:SiCl4<SiO2,
故答案为:>;<;
(2)硅晶体为一种空间网状结构的原子晶体,每个Si原子形成4个Si-Si,平均每个正四面体中含有四个最近且等距离的Si原子,其图为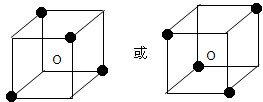 ;
;
故答案为: ;
;
(3)△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236kJ/mol,
故答案为:+236.
故答案为:>;<;
(2)硅晶体为一种空间网状结构的原子晶体,每个Si原子形成4个Si-Si,平均每个正四面体中含有四个最近且等距离的Si原子,其图为
 ;
;故答案为:
 ;
;(3)△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236kJ/mol,
故答案为:+236.
点评:本题考查了化学反应能量变化分析、反应热的计算、晶体结构等,把握原子晶体中键能和物质熔点的关系分析判断是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
一定量的CH4燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为49.6g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2g,则混合气体中CO的质量为( )
| A、24.4g |
| B、13.2g |
| C、12.5g |
| D、11.2g |
下列说法错误的是( )
| A、三个美国科学家因给复杂化学体系设计了多尺度模型而共享了2013年诺贝尔化学奖 |
| B、已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象 |
| C、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 |
| D、并不是所有金属元素都可以用焰色反应来确定其存在 |
下列做法不能体现“环境友好”思想的是( )
| A、汽油抗爆:甲基叔丁基醚代替四乙基铅 |
| B、处理废弃物:对废弃塑料露天焚烧 |
| C、工业制胆矾:使用稀硫酸、双氧水溶解铜 |
| D、火力发电:在燃煤中加入适量生石灰 |
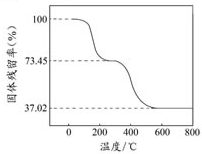 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.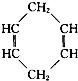 可简写为
可简写为 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 .
.