题目内容
10.将某一元醇与环己烷无论以任意比例混合,总物质的量一定时完全燃烧耗氧量不变,则该醇可能是( )| A. | 苯甲醇 | B. | 环己醇 | C. | 1-己醇 | D. | 间甲基苯甲醇 |
分析 有机物无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值,设有机物通式为CxHyOz,则(x+$\frac{y}{4}$-$\frac{z}{2}$)值相等,据此计算解答.
解答 解:环己烷(C6H12)消耗的氧气为(x+$\frac{y}{4}$-$\frac{z}{2}$)=6+$\frac{12}{4}$=9.
A.苯甲醇(C6H5CH2OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=7+$\frac{8}{4}$-$\frac{1}{2}$=8.5,故A错误;
B.环己醇(C6H11OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=6+$\frac{12}{4}$-$\frac{1}{2}$=8.5,故B错误;
C.1-己醇(C6H13OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=6+$\frac{14}{4}$-$\frac{1}{2}$=9,故C正确;
D.间甲基苯甲醇(CH3C6H4CH2OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=8+$\frac{10}{4}$-$\frac{1}{2}$=10,故D错误;
故选C.
点评 本题考查有机物耗氧量的计算,题目难度不大,根据烃及烃的含氧衍生物的燃烧通式,确定(x+$\frac{y}{4}$-$\frac{z}{2}$)值相等是关键.

练习册系列答案
相关题目
20.某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质.
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是H2(填化学式),写出此过程所发生的2个化学反应方程式:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4 +SO2↑+2H2O、Zn+2H2SO4=ZnSO4 +H2↑.
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)=4.48L.
(3)为证实相关分析,该小组的同学设计了如图1所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收).

①酸性KMnO4溶液的作用是除去二氧化硫气体;B中添加的试剂是浓硫酸.
②装置C中所装药品为CuO,可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色.
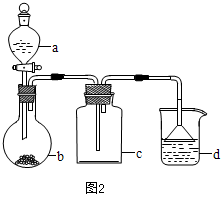
(4)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是H2(填化学式),写出此过程所发生的2个化学反应方程式:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4 +SO2↑+2H2O、Zn+2H2SO4=ZnSO4 +H2↑.
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)=4.48L.
(3)为证实相关分析,该小组的同学设计了如图1所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收).

①酸性KMnO4溶液的作用是除去二氧化硫气体;B中添加的试剂是浓硫酸.
②装置C中所装药品为CuO,可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色.
(4)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D

| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
1.在含1mol KAl(SO4)2的溶液中逐滴加入2mol Ba(OH)2溶液,下列有关说法中正确的是( )
| A. | 先生成沉淀,后沉淀全部溶解 | |
| B. | 当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大 | |
| C. | 最后得到的沉淀是BaSO4 | |
| D. | 最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
18. “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
 “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )| A. | 加热时,①中上部汇集了NH4Cl固体 | |
| B. | 加热时,②中溶液变红,冷却后又都变为无色 | |
| C. | 加热时,③中溶液变红,冷却后红色褪去,体现SO2的漂白性 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
5.化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据结构相似的分子的熔点与相对分子质量的关系,推出PH3比NH3熔点高 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
2.氮气和氮的化合物在工农业上生产、生活中有重要的用途.
(1)N2在空气中含量约78%,其性质稳定,可作保护气,常温下不与O2发生反应,但在闪电或者高温条件下可发生反应,标准装况下11.2L氮气与氧气反应吸收90kJ热量.
①写出N2与O2在放电条件下的热化学反应方程式N2(g)+O2(g)=2NO(g)△H=+180kJ/mol.
②根据NO的性质,收集NO气体的正确方法是排水法.(填“排水法”、“向上排空气法”或“向下排空气法”)
(2)为探究NH3的还原性,某实验小组设计了如下实验装置,其中A为NH3的制取装置如图1.

①下面是实验室制取NH3的装置如图2和选用的试剂,其中不合理的是ad
②选取合理的NH3的制取装置,小组开始实验,并发现了如下现象,同时小组对现象进行了讨论并得出了相应的结论:
分析上面的实验现象及结论,其中不合理的是Ⅱ(填序号),原因是无水CuSO4变蓝有可能是因为制取NH3时产生了H2O,不一定是氨气还原氧化铜生成的水.
(3)亚硝酸盐既有氧化性、又有还原性,常见的亚硝酸盐均有毒,但NaNO2是一种食品添加剂,使用时必须严格控制其用量.
在酸性溶液中,NaNO2能使淀粉-KI溶液变蓝色(同时得到一种常见的气体化合物),也能使酸性KMnO4溶液褪色,则前者反应过程中消耗的氧化剂与生成的氧化产物物质的量之比为2:1,后者反应的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
(1)N2在空气中含量约78%,其性质稳定,可作保护气,常温下不与O2发生反应,但在闪电或者高温条件下可发生反应,标准装况下11.2L氮气与氧气反应吸收90kJ热量.
①写出N2与O2在放电条件下的热化学反应方程式N2(g)+O2(g)=2NO(g)△H=+180kJ/mol.
②根据NO的性质,收集NO气体的正确方法是排水法.(填“排水法”、“向上排空气法”或“向下排空气法”)
(2)为探究NH3的还原性,某实验小组设计了如下实验装置,其中A为NH3的制取装置如图1.

①下面是实验室制取NH3的装置如图2和选用的试剂,其中不合理的是ad
②选取合理的NH3的制取装置,小组开始实验,并发现了如下现象,同时小组对现象进行了讨论并得出了相应的结论:
| 序号 | 现象 | 结论 |
| I | B装置中黑色氧化铜变为红色 | 反应生成了Cu或Cu2O |
| II | C装置中无水CuSO4变蓝 | 反应生成了H2O |
| III | E装置中收集到无色无味气体 | 反应生成了N2 |
(3)亚硝酸盐既有氧化性、又有还原性,常见的亚硝酸盐均有毒,但NaNO2是一种食品添加剂,使用时必须严格控制其用量.
在酸性溶液中,NaNO2能使淀粉-KI溶液变蓝色(同时得到一种常见的气体化合物),也能使酸性KMnO4溶液褪色,则前者反应过程中消耗的氧化剂与生成的氧化产物物质的量之比为2:1,后者反应的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
19.我国古代科技高度发达,下列古代文献的记载中,涉及化学变化的是( )
| A. | 《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒精和糟入瓯(指蒸锅),蒸令气上,用器承滴露.” | |
| B. | 《肘后备急方》记载“青蒿一握,以水二升渍,绞取汁.” | |
| C. | 《泉州府志》物产条载“初,人不知盖泥法,元时南有黄安长者为宅煮糖,宅坦忽坏,去土而糖白,后人遂效之.” | |
| D. | 《梦溪笔谈》记载“信州铅山县有苦泉,…挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜.” |