题目内容
5.下列有关氢化物的叙述中正确的是( )| A. | 稳定性:H2S>HF | B. | HCl的电子式为 | ||
| C. | H2O的摩尔质量为18 | D. | 在卤化氢中HI最稳定 |
分析 A.元素的非金属性越强,对应的氢化物越稳定;
B.HCl为共价化合物,组成原子最外层满足稳定结构;
C.H2O的相对分子质量为18,摩尔质量为18g/mol;
D.卤化氢中HF最稳定.
解答 解:A.非金属性:F>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2S<HF,故A错误;
B.HCl为共价化合物,组成原子最外层满足稳定结构,电子式为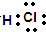 ,故B正确;
,故B正确;
C.H2O的相对分子质量为18,摩尔质量为18g/mol,故C错误;
D.卤族元素的非金属性F>Cl>Br>I,F的非金属性最强,则卤化氢中HF最稳定,故D错误.
故选B.
点评 本题考查较为综合,题目难度不大,学习中注意把握电子式的书写方法和元素周期律的递变规律.

练习册系列答案
相关题目
15.硫、硫化物和硫酸盐在自然界都存在.
(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
回答下列问题:
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:

①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.
(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:

①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.
16.下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱发生反应;
②弱酸与盐溶液反应可以生成强酸;
③没有水生成,也没有沉淀和气体生成的复分解反应;
④两种酸溶液充分反应后的溶液体系为中性;
⑤有单质参加的非氧化还原反应.
①酸性氧化物与碱发生反应;
②弱酸与盐溶液反应可以生成强酸;
③没有水生成,也没有沉淀和气体生成的复分解反应;
④两种酸溶液充分反应后的溶液体系为中性;
⑤有单质参加的非氧化还原反应.
| A. | ①②③④⑤ | B. | ②④⑤ | C. | ①②③⑤ | D. | ③④⑤ |
13.海洋中有丰富的食品、矿产、能源、药物和水产资源,图为海水利用的部分过程.下列有关说法正确的是( )


| A. | 制取NaHCO3的反应是利用其溶解度最小 | |
| B. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
20.某元素M2+核外电子数为24,该元素是下列原子中的( )
| A. | ${\;}_{24}^{52}$Cr | B. | ${\;}_{12}^{24}$Mg | C. | ${\;}_{26}^{56}$Fe | D. | ${\;}_{22}^{48}$Ti |
17.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e-═2CO32-+12H2O,7H2O+$\frac{7}{2}$O2+14e-═14OH-,有关此电池的推断正确的是( )
| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
14.指常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合下表信息判断不正确的是( )
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol -1 ) | 436 | 157 | 568 | 432 | 298[ |
| A. | H2(g)+F2(g)═2HF(g)△H=-25 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2(g)→2H(g)△H=+436 kJ•mol -1 | |
| D. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 |
15.在四种不同反应条件下,反应A(g)+B(g)=2C(g)+2D(g)的反应速率如下,其中反应最快的是( )
| A. | V(A)=0.15 mol•L-1•S-1 | B. | V(B)=0.3 mol•L-1•S-1 | ||
| C. | V(C)=0.4 mol•L-1•S-1 | D. | V(D)=0.45 mol•L-1•S-1 |
 氢氧燃料电池已用于航天飞机.如图为氢氧燃料电池构造示意图,其中A、B为气体进口,C1、C2均为石墨电极,电解质溶液为30%的氢氧化钾溶液.
氢氧燃料电池已用于航天飞机.如图为氢氧燃料电池构造示意图,其中A、B为气体进口,C1、C2均为石墨电极,电解质溶液为30%的氢氧化钾溶液.