题目内容
7.下列表示对应化学反应的离子方程式正确的是( )| A. | 氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+═Fe3++2H2O | |
| B. | 用氨水溶解氢氧化铜沉淀:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O | |
| C. | 用稀硝酸除去试管内壁银:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 向NaOH溶液中通入过量的CO2:CO2+2OH-═CO32-+H2O |
分析 A.发生氧化还原反应生成碘化亚铁、碘、水;
B.氢氧化铜在离子反应中保留化学式;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.反应生成碳酸氢钠.
解答 解:A.氢氧化铁胶体中加入HI溶液,离子方程式为2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A错误;
B.用氨水溶解氢氧化铜沉淀的离子反应为Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-,故B错误;
C.用稀硝酸除去试管内壁银的离子反应为3Ag+4H++NO3-═3Ag++NO↑+2H2O,故C正确;
D.向NaOH溶液中通入过量的CO2的离子反应为CO2+OH-═HCO3-,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.短周期元素X、Y、Z、M、W的原子序数增大,X的气态氰化物能使湿润的红色石蕊试纸变蓝,X与W最外层电子数之和等于Y最外层电子数的2倍,在短周期主族元素中Z的原子半径最大,M的最外层电子数是电子层数的2倍,下列说法不正确的是( )
| A. | Y的气态氢化物比X的稳定 | |
| B. | 元素M存在多种同素异形体 | |
| C. | Z与Y形成的化合物只含有离子键 | |
| D. | W的最高价氧化物对应水化物的酸性比M的强 |
18.a、b、c、d是原子序数依次增大的主族元素,它们的最外层电子数分别为4、1、x、7,c原子的电子层数等于x,下列说法正确的是( )
| A. | 元素a与氢元素能形成多种原子个数之比为1:1的化合物 | |
| B. | 元素b的单质不能与无水乙醇反应 | |
| C. | 元素c与元素d形成的化合物的水溶液呈碱性 | |
| D. | 元素a与元素d形成的化合物中肯定含有极性键,不可能含有非极性键 |
15. 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 mol O2反应,则迁移0.4 mol H+ | |
| C. | 正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O | |
| D. | 负极区溶液的pH减小 |
12.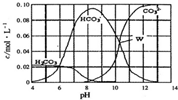 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c(Na+)+c(H+)=4c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol/L | |
| C. | pH=8的溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
19.某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
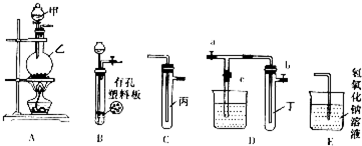
请按要求填空:
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下,请将表格中实验1的现象补充:
有同学认为实验II的结论合理,请说明理由实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡;
②若要利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱,则丙中所盛装的试剂为NaBr溶液,能得到结论的实验现象为试管中溶液由无色变为橙色;
③某同学用该装置探究氯气与KI的反应,在丙中盛放有KI淀粉溶液,通入氯气,看到丙中溶液变成蓝色,继续通氯气,发现蓝色逐渐消失,检测到溶液中有含+5价元素的酸根离子,则蓝色消失过量中丙中发生反应的化学方程式是5Cl2+I2+6H2O=2HIO3+10HCl.
(2)B、D、E装置相连后,在B中盛装铜片(放在有孔塑料板上)和浓硝酸,关闭c,打开a、b,即可在试管丁中收集到NO2.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②欲用D装置验证NO2与水的反应,在试管中收集满NO2后,使烧杯中的水进入试管丁的操作是(不可改变试管和烧杯的位置):先关闭止水夹ab,再打开止水夹c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.

请按要求填空:
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下,请将表格中实验1的现象补充:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有 较强的酸性 |
②若要利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱,则丙中所盛装的试剂为NaBr溶液,能得到结论的实验现象为试管中溶液由无色变为橙色;
③某同学用该装置探究氯气与KI的反应,在丙中盛放有KI淀粉溶液,通入氯气,看到丙中溶液变成蓝色,继续通氯气,发现蓝色逐渐消失,检测到溶液中有含+5价元素的酸根离子,则蓝色消失过量中丙中发生反应的化学方程式是5Cl2+I2+6H2O=2HIO3+10HCl.
(2)B、D、E装置相连后,在B中盛装铜片(放在有孔塑料板上)和浓硝酸,关闭c,打开a、b,即可在试管丁中收集到NO2.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②欲用D装置验证NO2与水的反应,在试管中收集满NO2后,使烧杯中的水进入试管丁的操作是(不可改变试管和烧杯的位置):先关闭止水夹ab,再打开止水夹c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.
16.下列说法不正确的是( )
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,准确读出反应体系的最高温度 | |
| B. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,加快油脂皂化反应速率 | |
| D. | 当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
17.下列有机物相关的表达式正确的是( )
| A. | 甲苯的结构式:C7H8 | B. | 乙烷的结构简式:CH3CH3 | ||
| C. | 甲醇的电子式:CH3OH | D. | 乙醇的分子式:CH3CH2OH |

