题目内容
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ?mol-1.实验测得起始、平衡时的有关数据如表所示:下列叙述正确的是( )
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出能量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A、容器①、②中反应达到平衡时所用的时间相等 |
| B、平衡时,两个容器中NH3的体积分数均为12.5% |
| C、容器②中达到平衡时放出的热量Q=23.15 kJ |
| D、若容器①体积为0.2 L,则平衡时放出的热量>23.15 kJ |
考点:反应热和焓变,化学平衡的影响因素
专题:
分析:反应速率与反应物的浓度有关;利用反应热计算生成氨气的物质的量,进而根据化学方程式计算生成氨气的体积分数;从平衡移动的角度比较反应放出的热量与23.15kJ的关系.
解答:
解:A、反应速率与反应物的浓度有关,反应物的浓度不同,则反应速率不同,所以到达平衡所用时间不同,故A错误;
B、①容器中放出23.15kJ热量,则生成氨气的物质的量为:
=0.5mol,利用三段式法计算:
N2(g)+3H2(g)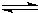 2NH3(g)△H=一92.6kJ/mol
2NH3(g)△H=一92.6kJ/mol
起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡时,①容器中NH3的体积分数等于气体的物质的量分数
=
,
从等效平衡的角度分析,1molN2、2.5molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,均为
≈14.3%,故B错误;
C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于23.15kJ,故C错误;
D、若容器①体积为0.2L,相当于在原来的基础上增大压强,平衡正向移动,平衡时放出的热量大于23.15kJ,故D正确.
故选D.
B、①容器中放出23.15kJ热量,则生成氨气的物质的量为:
| 2mol×23.15kJ |
| 92.6kJ |
N2(g)+3H2(g)
 2NH3(g)△H=一92.6kJ/mol
2NH3(g)△H=一92.6kJ/mol起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡时,①容器中NH3的体积分数等于气体的物质的量分数
| 0.5mol |
| 0.75mol+2.25mol+0.5mol |
| 1 |
| 7 |
从等效平衡的角度分析,1molN2、2.5molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,均为
| 1 |
| 7 |
C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于23.15kJ,故C错误;
D、若容器①体积为0.2L,相当于在原来的基础上增大压强,平衡正向移动,平衡时放出的热量大于23.15kJ,故D正确.
故选D.
点评:本题考查化学平衡移动问题,题目难度中等,注意B项从等效平衡的角度分析,为该题的易错点.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
反应2SO2+O2?2SO3,如果SO2的起始浓度为2mol?L-1,2min后SO2的浓度为1.8mol?L-1,则用SO2的浓度变化表示的化学反应速率为( )
| A、0.1 mol?L-1?min-1 |
| B、0.2mol?L-1?min-1 |
| C、0.9mol?L-1?min-1 |
| D、1.0mol?L-1?min-1 |
已知氨水的密度比水小,且浓度越大密度越小.溶质的质量分数分别为5%和25%的氨水等体积混合,混合后所得溶液中溶质的质量分数是( )
| A、15% | B、<15% |
| C、>15% | D、30% |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、同一物质的固、液、气三种状态的熵相同 |
| B、0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移 |
| C、等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等 |
| D、1.5 mol NO2与足量H2O反应,转移的电子数为2NA |
下列化合物中,属于盐的是( )
| A、H2O |
| B、Na2CO3 |
| C、HNO3 |
| D、KOH |
 已知A、B、C、D、E、F、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,W的+1价阳离子正好充满K,L,M三个电子层.回答下列问题:
已知A、B、C、D、E、F、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,W的+1价阳离子正好充满K,L,M三个电子层.回答下列问题: