题目内容
11.亚硝酸钠是重要的防腐剂.某化学兴趣小组以碳和浓硝酸为起始原料,设计如图装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(夹持装置和A中加热装置已略,气密性已检验),
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2═HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+.
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠.
回答下列问题:
(1)装置中仪器a的名称为三颈烧瓶;D装置的作用是除去未反应的NO,防止污染空气.
(2)A中反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;C中反应生成NaNO2的化学方程式是2NO+Na2O2=2NaNO2.
(3)检验C中产物有亚硝酸钠的正确操作是bc(填番号)
a.取少量生成物溶于水,滴加酚酞试液,若溶液变红,则含有NaNO2.
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2.
c.取少量生成物溶于水,加入酸性KMnO4溶液,若溶液紫色褪去,则含有NaNO2.
(4)经检验C产物中亚硝酸钠含量较少.
a.甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质.为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是碱石灰(写名称).
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是打开弹簧夹,通入N2一段时间.
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg.从1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是13.8mg/kg.
分析 (1)根据装置图可知仪器a的名称,实验中的尾气NO,会污染空气,所以要加以吸收;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,过氧化钠与NO反应会生成NaNO2;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)a、二氧化碳会和过氧化钠发生的反应,对反应产生干扰,需要除去;
b、为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气;
(5)依据电子得失守恒可知,亚硝酸钠与高锰酸钾(酸性)溶液发生氧化还原反应的关系式为5NaNO2~KMnO4,可计算出1000g隔夜熟肉中NaNO2的质量,并据此计算隔夜熟肉中NaNO2的含量.
解答 解:(1)根据装置图可知仪器a的名称为三颈烧瓶,实验中的尾气NO,会污染空气,所以D装置的作用是除去未反应的NO,防止污染空气,
故答案为:三颈烧瓶;除去未反应的NO,防止污染空气;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,反应方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,过氧化钠与NO反应会生成NaNO2,反应的化学方程为2NO+Na2O2=2NaNO2,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
(3)检验亚硝酸钠的实验设计为将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠,或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,
故选bc;
(4)a、为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
故答案为:碱石灰;
b.为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气,
故答案为:打开弹簧夹,通入N2一段时间;
(5)依据电子得失守恒可知,亚硝酸钠与高锰酸钾(酸性)溶液发生氧化还原反应的关系式为5NaNO2~2KMnO4,可计算出1000g隔夜熟肉中NaNO2的质量为2.5×0.00500mol/L×16.00mL×10-3×69=13.8mg,所以隔夜熟肉中NaNO2的含量为13.8mg/kg,
故答案为:13.8.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 2.8g C2H4和C3H6的混合物中含碳原子数为0.2×6.02×1023 | |
| B. | 在O2参与的反应中,1 mol O2做氧化剂时,得到电子数一定是4×6.02×1023 | |
| C. | 1 L 0.1 mol/L 的Na2S溶液中硫离子数为0.1×6.02×1023 | |
| D. | 标准状况下,11.2 L乙醇中氧原子数为0.5×6.02×1023 |
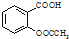 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点 (℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙烯水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)合成阿斯匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离.
另一种改进的提纯方法,称为重结晶提纯法.方法如下:

(4)改进的提纯方法中加热回流的装置如图所示

①使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
②重结晶提纯法所得产品的有机杂质要比原方案少的原因水杨酸易溶于乙酸乙酯,冷却结晶时大部分水杨酸仍溶解在乙酸乙酯中很少结晶出来.
(5)检验产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色,则含水杨酸.
(6)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
| A. | 碘酒 | B. | HCl(气态) | C. | 水煤气 | D. | 豆浆 |
| A. | NH3 | B. | BCl3 | C. | PCl3 | D. | H2O |
| A. | a=b | B. | a<b | C. | a>b | D. | 无法判断 |