题目内容
14.从高熔点氧化物中冶炼金属的常用方法是铝还原法,即铝热反应法.不能用铝热反应法从下列物质中冶炼金属的是( )| A. | 氧化镁 | B. | 氧化铁 | C. | 二氧化锰 | D. | 氧化镍 |
分析 铝能用于冶炼难熔的、活泼性比Al弱的金属(如Fe、Cr、Mn、W等),据此回答.
解答 解:反应放热,可以用铝热反应来进行难熔金属冶炼的冶炼,可以冶炼的金属是铁、铬、锰、钨、镍等,原理是金属铝和这些金属氧化物之间的置换反应,Mg活泼性比Al强,用电解法冶炼,所以不能用铝热反应法从下列物质中冶炼金属的是A.
故选A.
点评 本题考查金属的冶炼,题目难度不大,注意铝热反应的原理及应用,根据金属的活泼来判断金属的冶炼方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.茅台酒中存在少量具有凤梨香味的物质 X,其结构如图所示,下列说法正确的是( )

| A. | X 难溶于乙醇 | |
| B. | 酒中少量的丁酸能抑制 X 的水解 | |
| C. | X 完全燃烧后生成CO2和H2O的物质的量比为 1:2 | |
| D. | 分子式为 C4H8O2且官能团与 X 相同的物质共有 5 种 |
5.在一定温度下,盛有催化剂的体积一定的密闭容器中,通入一定量的SO3气体,发生分解反应2SO3?2SO2+O2,并达到平衡状态,测得SO3的分解率为75%.下列说法正确的是( )
| A. | 平衡后的压强为起始压强的1.25倍 | |
| B. | 平衡时混合气体的平均相对分子质量为64 | |
| C. | 混合气体的密度自始至终保持不变 | |
| D. | 取和SO3等质量的SO2和O2的混合气体,从逆反应开始并达到平衡,在相同条件下各物质的浓度与原来的平衡浓度一定相等 |
2.下列有关化学键和化合物的叙述正确的有几个( )
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤非金属原子间不可能形成离子键
⑥稀有气体中不存在共价键.
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤非金属原子间不可能形成离子键
⑥稀有气体中不存在共价键.
| A. | 2 个 | B. | 3个 | C. | 4个 | D. | 5个 |
9.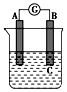 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Cu,B是Fe,C为稀Cu(NO3)2溶液 | D. | A是Fe,B是Ag,C为稀AgNO3溶液 |
19.除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是( )
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 氧化钙 | 蒸馏 |
| B | 乙酸乙酯(乙酸) | 饱和氢氧化钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
7.某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案:
(1)请写出实验步骤、预期现象,对应的离子方程式.
(限选试剂:铁粉、3mol/L H2SO4、0.1mol/L酸性KMnO4溶液、10% H2O2、KSCN溶液)
④操作步骤③中反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验.
已知:气体由草酸晶体受热分解得到:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+CO↑+3H2O.
且除铁红外所用试剂均过量.

①装置A、B中的试剂依次是氢氧化钠溶液、浓硫酸.
②气体通入后,接下来的操作是用点燃的小木条靠近肥皂泡,直到肥皂泡安静燃烧,然后对C装置加热.
③实验前后称得D装置增重8.8g,则此铁红中铁的质最分数是72.41%.
(1)请写出实验步骤、预期现象,对应的离子方程式.
(限选试剂:铁粉、3mol/L H2SO4、0.1mol/L酸性KMnO4溶液、10% H2O2、KSCN溶液)
| 操作步骤 | 预期现象 |
| ①取少量样品于试管中,加入足量的3mol/LH2SO4,充分振荡,将所得澄清的溶液分装在两支试管中. | |
| ②向一支试管中加入足量铁粉,充分振荡;再加入足量3mol/LH2SO4,充分振荡. | 若出现红色固体,则含有CuO. |
| ③向另一支试管中加入0.01mol/L酸性KMnO4溶液. | 若溶液紫红色褪去则含有FeO. |
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验.
已知:气体由草酸晶体受热分解得到:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+CO↑+3H2O.
且除铁红外所用试剂均过量.

①装置A、B中的试剂依次是氢氧化钠溶液、浓硫酸.
②气体通入后,接下来的操作是用点燃的小木条靠近肥皂泡,直到肥皂泡安静燃烧,然后对C装置加热.
③实验前后称得D装置增重8.8g,则此铁红中铁的质最分数是72.41%.
4.现用邻苯二甲酸氢钾标准溶液来测定某NaOH溶液的浓度,进行如下操作:
步骤I:用天平精确称取5.207 g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成 250 mL标准溶液.
步骤Ⅱ:移取25.00 mL标准溶液于250 mL锥形瓶中,加入1~2滴酚酞试液,用NaOH待测溶液滴定至终点.再按上述方法重复操作2次.
(1)操作I中,所得邻苯二甲酸氢钾标准溶液的物质的量浓度是0.1020 mol/L.
(2)滴定结果记录如下:
①滴定过程中发生反应的化学方程式是(有机物写结构简式) .
.
②待测NaOH溶液的物质的量浓度为0.1275 mol/L.
(3)根据步骤Ⅱ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH待测溶液进行滴定,则测得NaOH溶液的浓度偏低(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH待测溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
④滴定终点时溶液的颜色如何变化?由无色变为浅红色,半分钟内不褪色.
步骤I:用天平精确称取5.207 g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成 250 mL标准溶液.
步骤Ⅱ:移取25.00 mL标准溶液于250 mL锥形瓶中,加入1~2滴酚酞试液,用NaOH待测溶液滴定至终点.再按上述方法重复操作2次.
(1)操作I中,所得邻苯二甲酸氢钾标准溶液的物质的量浓度是0.1020 mol/L.
(2)滴定结果记录如下:
| 滴定次数 | 标准溶液的体积/mL | 待测溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 21.98 |
| 3 | 25.00 | 0.20 | 20.20 |
 .
.②待测NaOH溶液的物质的量浓度为0.1275 mol/L.
(3)根据步骤Ⅱ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH待测溶液进行滴定,则测得NaOH溶液的浓度偏低(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH待测溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
④滴定终点时溶液的颜色如何变化?由无色变为浅红色,半分钟内不褪色.
