题目内容
5.氮及其化合物在生产、生活中有着重要的作用.请回答下列问题:
(1)图1是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
(2)在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)?2NO2(g)△H如图2
①在0-60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1.
②温度升高,混合气体的颜色变深,则△H>0(填“>”或“<”).
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有ac(填字母).
a.向混合气体中通入N2O4 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2,反应2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液.
①A、B两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离
常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1).
②可使A、B两溶液的PH相等的方法是bc(填字母).
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:
Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平).0.6molCu被硝酸完全溶解后,如果得到的
NO和NO2物质的量相同,则参加反应的硝酸的物质的量为1.8mol.
分析 (1)反应热等于正反应的活化能减去逆反应的活化能,注明物质的聚集状态与反应热书写热化学方程;
(2)①根据v=$\frac{△c}{△t}$计算v(N2O4);
②温度升高,混合气体的颜色变深,说明升高温度平衡向生成NO2的方向移动;
③a.向混合气体中通入N2O4,等效为在原平衡基础上增大压强到达的平衡;
b.升高温度,平衡向吸热反应方向移动;
c.向混合气体中通入NO2,等效为在原平衡基础上增大压强到达的平衡;
d.使用高效催化剂不影响平衡移动;
(3)溶液A中NaNO3、NaNO2的浓度均为0.1mol/L,HNO2、CH3COOH均为弱酸,由电离常数可知CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液;
(4)参加反应的硝酸转化为Cu(NO3)2、NO、NO2,根据Cu原子守恒计算Cu(NO3)2的物质的量,根据电子转移守恒计算NO、NO2的物质的量,再根据氮原子守恒计算消耗硝酸物质的量.
解答 解:(1)该反应的焓变△H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol;
(2)①由图可知,在0-60s时段△c(N2O4)=0.1mol/L-0.04mol/L=0.06mol/L,则v(N2O4)=$\frac{0.06mol/L}{60s}$=0.001mol/(L.min),
故答案为:0.001;
②温度升高,混合气体的颜色变深,说明升高温度平衡向生成NO2的方向移动,升高温度平衡向吸热反应移动,则△H>0,
故答案为:>;
③a.向混合气体中通入N2O4,等效为在原平衡基础上增大压强到达的平衡,平衡逆向移动,N2O4的体积分数增大,故a正确;
b.正反应为吸热反应,升高温度平衡向正反应方向移动,N2O4的体积分数减小,故b错误;
c.向混合气体中通入NO2,等效为在原平衡基础上增大压强到达的平衡,N2O4的体积分数增大,故c正确;
d.使用高效催化剂缩短到达平衡的水解,不影响平衡移动,N2O4的体积分数不变,故d错误,
故答案为:ac;
(3)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量浓度为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-),
a.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故a错误;
b.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故b正确;
c.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故c正确;
d.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故d错误;
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-);bc;
(4)参加反应的硝酸转化为Cu(NO3)2、NO、NO2,根据Cu原子守恒可知n[Cu(NO3)2]=n(Cu)=0.6mol,得到的NO和NO2物质的量相同,根据电子转移守恒,则:3n(NO)+n(NO2)=0.6mol×2,故n(NO)=n(NO2)=0.3mol,根据氮原子守恒,可知n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=0.6mol×2+0.3mol+0.3mol=1.8mol,
故答案为:1.8mol.
点评 本题考查热化学方程式书写、化学反应速率计算、化学平衡影响因素、盐类水解、氧化还原反应计算等,注意等效思想在化学平衡移动中应用,守恒思想在化学计算中应用.

| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |

已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(2)本流程中产生的CO2和H2,在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为HCOOH(l)+$\frac{1}{2}$O2(g)═CO2(g)+H2O(g);△H=-254.6kJ/m.
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
| A. | 原素Z、W的简单离子的电子层结构不同 | |
| B. | Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| X | Y | ||
| Z | W | Q |
| A. | 阴离子的还原性:W2-<Q-<Y- | |
| B. | 常温下,X2与W的单质间化合反应不能自发进行 | |
| C. | ZX2是两性氧化物 | |
| D. | Y的氢化物可用来篆刻玻璃 |
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.
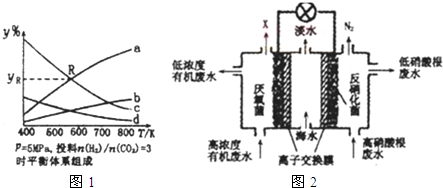
完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
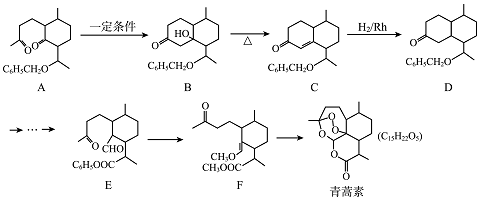
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.

 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.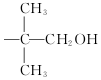 基团;
基团; +2H2O.
+2H2O.