题目内容
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
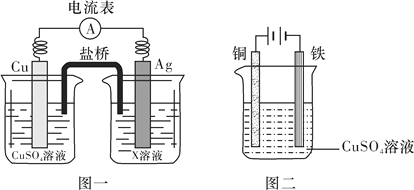
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
【答案】 CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 1 浅红色 -483.6 强 正反应 减小 未达到 AgNO3 Cu2++2e-===Cu
+OH- 1 浅红色 -483.6 强 正反应 减小 未达到 AgNO3 Cu2++2e-===Cu
【解析】(1)①Na2CO3是强碱弱酸盐,水解呈碱性:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-;②硫酸属于二元强酸,所以0.05mol/L的硫酸中的氢离子浓度为:0.05
+OH-;②硫酸属于二元强酸,所以0.05mol/L的硫酸中的氢离子浓度为:0.05![]() 2=0.1mol/L,pH=1;③酚酞遇酸显无色,遇碱变红,用0.0100 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色,且半分钟内保持不变;(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,生成2 mol H2O(g)时放出483.6 kJ的热量,反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol;②已知:C(石墨,s)===C(金刚石,s) ΔH>0,由能量越低越稳定知,则稳定性石墨比金刚石强;(3)①可逆反应FeO(s)+CO(g)
2=0.1mol/L,pH=1;③酚酞遇酸显无色,遇碱变红,用0.0100 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色,且半分钟内保持不变;(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,生成2 mol H2O(g)时放出483.6 kJ的热量,反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol;②已知:C(石墨,s)===C(金刚石,s) ΔH>0,由能量越低越稳定知,则稳定性石墨比金刚石强;(3)①可逆反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g)达到平衡后,向容器中通入CO,反应物的浓度增大,化学平衡向正反应方向移动;②反应FeO(s)+CO(g)
Fe(s)+CO2(g)达到平衡后,向容器中通入CO,反应物的浓度增大,化学平衡向正反应方向移动;②反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0为吸热反应,若降低温度,平衡正向移动,平衡常数K增大;③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,Q=
Fe(s)+CO2(g) ΔH>0为吸热反应,若降低温度,平衡正向移动,平衡常数K增大;③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,Q=![]() 此时刻反应未达到平衡状态;(4)①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),溶液中银离子得电子产生银,故X溶液是AgNO3溶液;②图二装置在铁件上镀铜,铁作阴极,则阴极上铜离子得电子产生铜的电极反应式是Cu2++2e-===Cu。
此时刻反应未达到平衡状态;(4)①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),溶液中银离子得电子产生银,故X溶液是AgNO3溶液;②图二装置在铁件上镀铜,铁作阴极,则阴极上铜离子得电子产生铜的电极反应式是Cu2++2e-===Cu。

 考前必练系列答案
考前必练系列答案