题目内容
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为____________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:___________,并设计实验方案验证该反应的产物:______。
【答案】)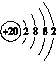
![]() CaFe(CO3)2CaFe(CO3)2
CaFe(CO3)2CaFe(CO3)2![]() CaO+FeO+2CO2↑4Fe(OH)2+2H2O+O2=4Fe(OH)32FeO+CO2
CaO+FeO+2CO2↑4Fe(OH)2+2H2O+O2=4Fe(OH)32FeO+CO2![]() Fe2O3+CO检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色
Fe2O3+CO检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色
【解析】
因X与盐酸反应生成气体甲,则X应为弱酸盐,又因X受热分解可生成气体甲和固体1,可推知固体1应为金属氧化物。因固体1中有与水反应的物质,且溶液1中通入气体甲先出现白色沉淀1后溶解,可推知固体1中含有CaO,气体甲为CO2。根据白色沉淀2遇到空气变为红褐色沉淀,可知X中含有Fe2+。综上分析,X应含有FeCO3和CaCO3。 (1)白色沉淀1为CaCO3,钙原子的结构示意图为 ;CO2为共价化合物,C、O原子间以共价键结合,其电子式为
;CO2为共价化合物,C、O原子间以共价键结合,其电子式为![]() ; (2)10.80 g X完全分解生成CO2的质量为10.80 g-6.40 g=4.40 g,其物质的量为0.10 mol,根据CaCO3
; (2)10.80 g X完全分解生成CO2的质量为10.80 g-6.40 g=4.40 g,其物质的量为0.10 mol,根据CaCO3![]() CaO+CO2↑、FeCO3
CaO+CO2↑、FeCO3![]() FeO+CO2↑可得:n(FeO)+n(CaO)=0.1 mol,56 g·mol-1×n(CaO)+72 g·mol-1×n(FeO)=6.40 g,解以上两式可得:n(FeO)=n(CaO)=0.050 mol,则X的化学式为CaFe(CO3)2。X在惰性气流中受热至完全分解的化学方程式为CaFe(CO3)2
FeO+CO2↑可得:n(FeO)+n(CaO)=0.1 mol,56 g·mol-1×n(CaO)+72 g·mol-1×n(FeO)=6.40 g,解以上两式可得:n(FeO)=n(CaO)=0.050 mol,则X的化学式为CaFe(CO3)2。X在惰性气流中受热至完全分解的化学方程式为CaFe(CO3)2![]() CaO+FeO+2CO2↑。 (3)Fe(OH)2被空气中的O2氧化为Fe(OH)3,其化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3。(4)高温下FeO与CO2反应生成CO,另一种产物可能是Fe2O3。将反应后所得到的固体用稀硫酸溶解,然后用KSCN溶液检验是否含有Fe3+,将气体产物通过热的CuO固体,根据固体变红色可确定CO2中有CO。检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色。
CaO+FeO+2CO2↑。 (3)Fe(OH)2被空气中的O2氧化为Fe(OH)3,其化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3。(4)高温下FeO与CO2反应生成CO,另一种产物可能是Fe2O3。将反应后所得到的固体用稀硫酸溶解,然后用KSCN溶液检验是否含有Fe3+,将气体产物通过热的CuO固体,根据固体变红色可确定CO2中有CO。检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色。